
| A、小苏打的电离:NaHCO3?Na++H++CO32- |
| B、苏打溶液呈碱性:CO32-+2H2O?H2CO3+2OH- |
| C、FeCl3溶液与Na2S溶液混合:2Fe3++3S2-+6H2O═2Fe(OH)3↓+3H2S↑ |
| D、NaAlO2溶液中通入少量CO2气体:2AlO2-+CO2+3H2O═2Al(OH)3↓+CO32- |


科目:高中化学 来源: 题型:
| A、0.15 mol?L-1 |
| B、0.2 mol?L-1 |
| C、0.3 mol?L-1 |
| D、0.4 mol?L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
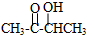 )是一种有奶香味的香料.以丙酮为主要原料合成3-羟基丁酮,并能进一步合成多种高聚物,其中聚对苯二甲酸-2,3-丁二醇酯(PBT)是最坚韧的工程热塑材料之一.合成线路如下:
)是一种有奶香味的香料.以丙酮为主要原料合成3-羟基丁酮,并能进一步合成多种高聚物,其中聚对苯二甲酸-2,3-丁二醇酯(PBT)是最坚韧的工程热塑材料之一.合成线路如下: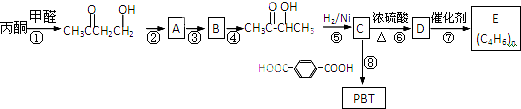
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、镀层破损后,白铁皮(镀锌铁板)比马口铁(镀锡铁板)更耐腐蚀 |
| B、埋在潮湿地下的铁管道比地上的铁管道更耐腐蚀 |
| C、钢铁发生析氢腐蚀时,正极上发生的电极反应式为:Fe-3e-=Fe 3+ |
| D、在钢铁表面涂上一层油漆,不能达到防止钢铁锈蚀 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、由H2(g)、I2(g)、HI(g)组成的混合气体平衡体系加压后颜色加深 |
| B、久置的氯水变成了稀盐酸 |
| C、在FeCl3溶液中加入铁粉防止氧化变质 |
| D、加入催化剂有利于SO2与O2反应制SO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、C2H4、C2H6O |
| B、C2H2、C6H6 |
| C、CH2O、C3H6O |
| D、CH4、C2H4O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、常温下,水分解产生O2,此时平衡常数的值约为5×10-80 | ||
| B、常温下,最易分解放出O2的是水 | ||
C、K3=
| ||
| D、以上都不正确 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com