
| 1 |
| 3 |
| ��c |
| ��t |
| ��c |
| ��t |
| 1.0mol/L |
| 20s |
| c(C) |
| c(A)?c(B) |
| c(C) |
| c(A)?c(B) |
| 1mol/L |
| 1mol/L��1mol/L |
| x |
| (2+b-x)(2-x) |
| 1 |
| 3 |
| x |
| 4+b-x |
| 1 |
| 3 |
| 0.1000mol?L-1��20mL |
| 60mL |
| Ksp |
| C(SO42-) |
| 9.10��10-6 |
| 1.00 |



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
 ����������һ���Ч���Ͷ������������ǿ�Ҵ�ɱ���õ�ɱ��������жԹ��ȶ�����������Ľṹ��ʽ��ͼ�����жԸû���������������ǣ�������
����������һ���Ч���Ͷ������������ǿ�Ҵ�ɱ���õ�ɱ��������жԹ��ȶ�����������Ľṹ��ʽ��ͼ�����жԸû���������������ǣ�������| A���������� |
| B���û����������ٺ����ֹ����� |
| C����һ�������¿ɷ���ȡ����Ӧ |
| D����һ�������¿ɷ����ӳɷ�Ӧ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A����������ͬ���ܱ������г���3He��O2�������ǵ��¶Ⱥ��ܶȶ���ͬʱ���������������ѹǿ����� | ||||
| B��3He��������Ϊ3������3Heԭ�ӵĽ������ԭ������Ϊ3 | ||||
C��
| ||||
| D�������ͬ���ܶ���ͬ��3He��HD������ͬ�������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
 �����£��������ؾ��壨KO2����������ṹ����ͼΪ�������ؾ����һ������������˵����ȷ���ǣ�������
�����£��������ؾ��壨KO2����������ṹ����ͼΪ�������ؾ����һ������������˵����ȷ���ǣ�������| A��KO2�мȴ������Ӽ����ִ��ڹ��ۼ� | ||
B��ÿ����������1��K+��1��O
| ||
C����������ÿ��K+���������O
| ||
| D�������У�����ԭ��֮�䶼�������Ӽ���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
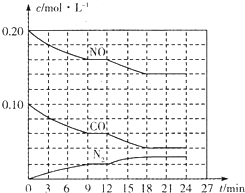 Ϊ��Ч�������������ػ�����ȡ��ʩ���ƴ�����������Ч���ƿ����е������̼����������������Ե���Ϊ��Ҫ��
Ϊ��Ч�������������ػ�����ȡ��ʩ���ƴ�����������Ч���ƿ����е������̼����������������Ե���Ϊ��Ҫ���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
 ��������и��⣺�ڢ�A����AԪ����ɵĻ�����GaN��GaP��GaAs�����˹��ϳɵ����Ͱ뵼����ϣ��侧��ṹ����ʯ���ƣ�
��������и��⣺�ڢ�A����AԪ����ɵĻ�����GaN��GaP��GaAs�����˹��ϳɵ����Ͱ뵼����ϣ��侧��ṹ����ʯ���ƣ��鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com