
【题目】下列有关实验现象和解释或结论都正确的是()
选项 | 实验操作 | 现象 | 解释或结论 |
A | 把SO2通入紫色石蕊试液中 | 紫色先变红后褪色 | SO2具有漂白性 |
B | 向AgCl沉淀中清加KI溶液 | 白色沉淀变为黄色 | 溶度积:AgI比AgCl更小 |
C | 将充满NO2的密闭玻璃球浸泡在热水中 | 红棕色变浅 | 反应2NO2 |
D | 把浓硫酸滴到pH试纸上 | 试纸变红 | 浓硫酸具有酸性 |
A. AB. BC. CD. D
【答案】B
【解析】
A.把SO2通入紫色石蕊试液中,发生反应:SO2+H2O=H2SO3,亚硫酸是二元酸,电离产生H+,使溶液显酸性,可以使紫色石蕊试液变为红色,A错误;
B.AgCl在溶液中存在沉淀溶解平衡:AgCl(s)![]() Ag+(aq)+Cl-(aq),当向溶液中加入KI溶液时,由于溶液中c(Ag+)·c(I-)>Ksp(AgI),会发生反应:Ag++I-=AgI↓,产生黄色沉淀,AgCl沉淀不断溶解,沉淀逐渐由白色转化为黄色,B正确;
Ag+(aq)+Cl-(aq),当向溶液中加入KI溶液时,由于溶液中c(Ag+)·c(I-)>Ksp(AgI),会发生反应:Ag++I-=AgI↓,产生黄色沉淀,AgCl沉淀不断溶解,沉淀逐渐由白色转化为黄色,B正确;
C. NO2气体存在化学平衡:2NO2![]() N2O4,将充满NO2的密闭玻璃球浸泡在热水中,气体颜色加浅,是由于升高温度,平衡向吸热的正反应方向移动,所以△H>0,C错误;
N2O4,将充满NO2的密闭玻璃球浸泡在热水中,气体颜色加浅,是由于升高温度,平衡向吸热的正反应方向移动,所以△H>0,C错误;
D.浓硫酸电离产生H+,使试纸变为红色,但同时浓硫酸具有脱水性,会使试纸中的H、O两种元素以水的组成脱去,试纸变为黑色C单质,所以把浓硫酸滴到pH试纸上,试纸先红色,最后变为黑色,D错误;
故合理选项是B。


 愉快的寒假南京出版社系列答案
愉快的寒假南京出版社系列答案科目:高中化学 来源: 题型:
【题目】下表为元素周期表前三周期的一部分:

(1)判断 Y ____ Z _____ R _____(写元素符号)。
(2)写出X的氢化物的化学式:_________,W的氢化物的化学式_________,其沸点比较: ________>________ ______________ (填化学式)
(3)下图是X的基态原子的电子排布图,其中有一个是错误的,它不能作为基态原子的电子排布 图是因为它不符合________。


(4)以上五种元素中,________(填元素符号)元素第一电离能最大。_____元素电负性最大,Y的基态原子的电子排布式为________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知卤代烃在碱性条件下可以发生如下水解反应:(R 代表烃基)R—X+NaOH![]() R—OH+NaBr。A、B、C、D、E、F、G、H 八种有机化合物有如下转换关系,部分化合物的分子式已给出。
R—OH+NaBr。A、B、C、D、E、F、G、H 八种有机化合物有如下转换关系,部分化合物的分子式已给出。
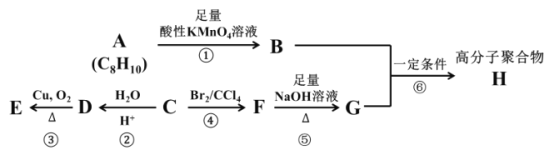
其中,某烃 C 是重要的石油化工产品,其产量可以用来衡量一个国家的石油化工发展水平。化合物 A 属于芳香烃,且苯环上的所有氢原子等效(处于相同的化学环境)。高分子聚合物 H 是工业上重要的聚酯纤维,被大量用于制作矿泉水瓶和衣物纤维。请根据上述信息,回答下列问题:
(1)化合物 A 的结构简式为 _______,A 的二氯代物有____种,A 的分子中最多可能有____个原子共平面。
(2)反应②的反应类型是 _____,化合物 D 中官能团的名称为 ______。
(3)请写出反应③的化学反应方程式______。
(4)请写出反应⑥的化学反应方程式______,并指出该反应的反应类型:_____。
(5)二取代芳香族化合物 I 是化合物 B 的同分异构体,且满足下列条件:
①能发生银镜反应;②不能与NaHCO3 溶液反应生成CO2;③苯环上只含有一种取代基
试写出 I 的任意两种可能的结构简式:______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示装置中:b电极用金属M制成,a、c、d为石墨电极,接通电源,金属M沉积于b极,同时a、d电极上产生气泡。试回答
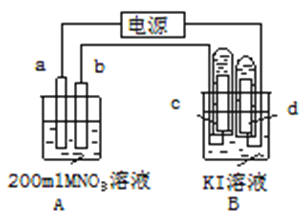
(1)a连接电源的__________极。b极的电极反应式为______________________________。
(2)电解开始时,在B烧杯的中央,滴几滴淀粉溶液,你能观察到的现象是:_______________,电解进行一段时间后,罩在C极上的试管中也收集到了气体。此时C极上的电极反应式为________________________________
(3)当d极上收集到44.8mL气体(标准状况)时停止电解,a极上放出了__________mol气体,若在b电极上沉积金属M的质量为0.432g,则此金属的摩尔质量为___________。
(4)电解停止后加蒸馏水使A烧杯中的溶液体积仍为200mL。取该溶液逐滴加入到25.0mL0.1mol/L HCl溶液中,当加入25.00mL这种溶液时刚好沉淀完全。试计算电解前A烧杯中MNO3溶液的物质的量浓度为__________mol/L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用0.1320mol/L的HCl溶液滴定未知浓度的NaOH溶液,实验数据如下表所示,
实验编号 | 待测NaOH溶液的体积/mL | HCl溶液的体积/mL |
1 | 25.00 | 24.41 |
2 | 25.00 | 24.39 |
3 | 25.00 | 24.60 |
回答下列问题:
(1)如图中甲为___________滴定管,乙为_________ 滴定管(填“酸式”或“碱式 ”)
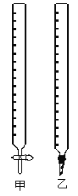
(2)实验中,需要润洗的仪器是:________________________
(3)取待测液NaOH溶液25.00ml 于锥形瓶中,使用酚酞做指示剂。滴定终点的判断依据是________________________________________
(4)若滴定前,滴定管尖端有气泡,滴定后气泡消失,将使所测结果____________(填“偏高”“偏低”“不变”,下同);若读酸式滴定管读数时,滴定前仰视读数,滴定后正确读数,则所测结果___________。
(5) 未知浓度的NaOH溶液的物质的量浓度为_____________mol/l。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列用于解释事实的离子方程式不正确的是( )
A.向AgCl悬浊液中加入Na2S溶液,有黑色难溶物生成:2AgCl(s)+S2-(aq)![]() Ag2S(s)+2Cl-(aq)
Ag2S(s)+2Cl-(aq)
B.向酸性KMnO4溶液中加入NaHSO3固体,溶液紫色褪去:2MnO4-+5HSO3-+H+=2Mn2++5SO42-+3H2O
C.向NaHCO3溶液中加入过量澄清石灰水,有白色沉淀生成:2HCO3-+Ca2++2OH-=CaCO3↓+2H2O+CO32-
D.向稀硝酸中加入铜粉,溶液变蓝色:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】侯氏制碱法原理:NaCl+H2O+CO2+NH3=NaHCO3↓+NH4Cl,下列相关化学用语正确的是
A.中子数为8的氮原子:![]()
B.氧原子的结构示意图: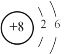
C.NaHCO3的电离方程式:NaHCO3=Na++H++![]()
D.CO2的球棍模型:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,向50mL含有0.1molCl2的氯水中滴加2mol·L1的NaOH溶液,得到溶液pH随加入NaOH溶液体积的变化如图所示。下列说法正确的是
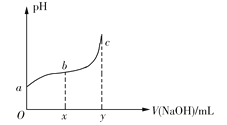
A.若a点pH=4,且c(Cl)=mc(HClO),则HClO的电离平衡常数为![]()
B.若x=100,b点对应溶液中,c(OH)>c(H+),可用pH试纸测定其pH
C.若y=200,c点对应溶液中,c(OH)c(H+)=2c(Cl)+c(HClO)
D.b→c段,随NaOH溶液的滴入,![]() 逐渐增大
逐渐增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应2SO3(g)![]() 2SO2(g) + O2(g)的能量与反应进程如图(a) 所示;在恒容密闭容器中充入SO3(g),T1°C测得其中的SO3(g)和O2(g)的浓度随时间变化如图(b) 所示。下列说法正确的是
2SO2(g) + O2(g)的能量与反应进程如图(a) 所示;在恒容密闭容器中充入SO3(g),T1°C测得其中的SO3(g)和O2(g)的浓度随时间变化如图(b) 所示。下列说法正确的是
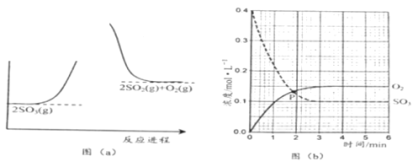
A.由图(a) 知,正反应为放热反应
B.图(b)中,SO3分解的平均速率0~1min比1~2min慢
C.图(b)中,P点时反应达到平衡状态
D.由图(b)知,SO2的平衡浓度为0.3mol·L-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com