
������Ⱦ������������ȫ���ע����ҵ�����в�����SO2��NO��Ϊ��Ҫ��Ⱦ���������ѧ��ѧ֪ʶ����������⣺
��1��PM2.5��ָ������ֱ��С�ڻ����2.5��m��1��m=103nm���Ŀ��������˵������ȷ����_________������ĸ��ţ���
a��PM2.5��Ҫ��Դ�ڻ������硢��ҵ����������β���ŷŵȹ���
b��PM2.5����С�����Զ�������
c��ֱ������1��2.5��m�Ŀ������ɢ�������п��γɽ���
d���ƹ�ʹ�õ綯���������Լ���PM2.5����Ⱦ
��2��SO2Ϊ��Ҫ�ĺ�������γ��������Ҫ��Ⱦ��֮һ����ʵ�����У�����70%��������Һ���������Ʒ�ĩ��Ӧ��ȡ��������Ҫ����Ʒ�Ӧ���ʣ���ѡ����ͼ��ʾ���巢��װ���е�_______�������������ĸ����

��3��Ϊ�о�SO2�����ʣ���ͼ��ע�����м�������Na2SO3���壬����������Ũ���ᣨ�Բ��Ӵ�ֽ��������
�����й�˵����ȷ����___________

A����ɫʯ����ֽ�ȱ�����ɫ
B��ʪ���Ʒ����ֽ��պ��KMnO4��Һ����ֽ����ɫ֤��SO2����Ư����
C��ʪ��ĵ���KI����ֽδ����˵��SO2��������ǿ��I2
D��NaOH��Һ�����ڳ�ȥʵ���ж����SO2
��4��һ���¶��£����ܱ�������SO2��O2��Ӧ����1molSO3����ʱ���ų�akJ������
�ٸ��¶���SO2��O2��Ӧ���Ȼ�ѧ����ʽΪ__________________________��
����֪��2NO(g)+O2(g)�T2NO2(g) ��H= -b kJ•mol-1 ��a��b��0��
��ӦNO2(g)+SO2(g)�TSO3(g)+NO(g) �ġ�H=________________��
�����Ṥҵβ���ж�������ĺ�������0.05%�����������ʱ��Ҫ����������ŷš�ijУ��ѧ��ȤС�����ⶨij���Ṥ���ŷ�β���еĶ�������ĺ������������·�����
ʵ�鲽������ͼ����ͼ��ʾ��

��1��������з�Ӧ�����ӷ���ʽΪ____________________________��
��2���������Ba(OH)2�Ƿ��������жϷ�����____________________________��
��ҵ�����в�����SO2��NOֱ���ŷŽ��Դ������������Ⱦ�����õ绯ѧԭ������SO2��NO��ͬʱ��� Na2S2O4�� NH4NO3��Ʒ�Ĺ�������ͼ���£�CeΪ��Ԫ�أ���

��ش��������⣮
��1��װ�â��еķ�Ӧ�����������½��У�д��NO������ΪNO2-�����ӷ���ʽ__________��
��2��װ�â������֮һ������Ce4+����ԭ����ͼ��ʾ��
ͼ��AΪ��Դ��______���������������.�Ҳ෴Ӧ���з�������Ҫ�缫��ӦʽΪ__________��
��3����֪����װ�â�����Һ��NO2-��Ũ��Ϊ 0.75mol/L��Ҫʹ 1m3����Һ�е�NO2-��ȫת��Ϊ NH4NO3����������װ�â���ͨ���״���µ� O2�����Ϊ_______L��

| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ��2015-2016ѧ�꽭��ʡ��һ�ϵ����ο��Ի�ѧ�Ծ��������棩 ���ͣ�ѡ����
�о���Ӧ��Ļ�ѧ�����������֮��Ĺ�ϵʱ��ʹ����������ķ��������յ���ֱ�������Ч�������б��ﲻ��ȷ����
A���ܱ�������CuO��C���·�Ӧ��������
B��Na2O2�͵����ʵ�����CO2��H2O(g)��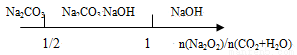
C��NaOH��Һ��ͨ��һ������CO2�IJ��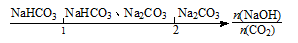
D��AlCl3��Һ�еμ�NaOH��Һ����ϵ����Ԫ�صĴ�����ʽ��
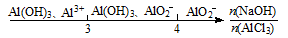
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015-2016ѧ�����ɹŰ�ͷ���и�һ��12���¿���ѧ�Ծ��������棩 ���ͣ�ѡ����
����˵���У���ȷ����
A��SO2������ˮ��ˮ��Һ�ܵ��磬����SO2�ǵ����
B��NaCl��Һ�ܵ�������Ϊ��Һ���������ƶ���Na����Cl��
C��H2SO4�ڵ�����������ˮ�е����H����SO42��
D���������Һ�м�����������������Һ�����ڷ����кͷ�Ӧ����Һ�ĵ�����������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015-2016ѧ��ɽ��ʡ��һ��11���¿���ѧ�Ծ��������棩 ���ͣ�ѡ����
����������ȷ����
A����28gCO������ͬ��������CO2������һ����44 g
B����V LCO������ͬ��������CO2�����һ����V L
C������ԭ������ȵ�CO��CO2���ܶ�֮��Ϊ7��11
D������ԭ������ȵ�CO��CO2���ܶ�֮��Ϊ21��22
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015-2016ѧ��ɽ��ʡ��һ��12���¿���ѧ�Ծ��������棩 ���ͣ�ѡ����
����˵����ȷ����
A������θ����࣬����NaHCO3��������Al(OH)3�����京��AlԪ��
B��Al����ɰֽ��ĥ���ڿ��������ȿ����ۻ�����������Ĥ���ƻ����ۻ���Al���Ե���
C���ò�˿����ɫ��Ӧʵ�飬ÿ���������Ҫ������ϴ�ӣ������������ƾ��ƻ�����ɫ��ͬ����ʹ��
D��ʵ�����Ʊ�Al(OH)3ʱ����ˮ���˹�������ΪAl(OH)3�������Ũ��ˮ��Ӧ����NH4AlO2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016������ʡ������ѧ��12��ģ�⻯ѧ�Ծ��������棩 ���ͣ�ѡ����
�����й�ʵ�������ơ������¼�����۽��Ͷ���ȷ����
ʵ�������� | �����¼ | ���۽��� | |
A | ������ǯ��ס�����ھƾ��� �ϼ��� | �����ۻ����������� | �۵㣺Al2 O3��Al |
B | ��Ũ����ε�pH��ֽ�� | ��ֽ��� | Ũ����������� |
C | ��ij�Ȼ�������Һ�м��� Na2O2��ĩ | ���ֺ��ɫ���� | ����Na2O2��ĩǰ��ԭ�Ȼ� ������Һ�Ѿ����� |
D | �ýྻ��˿պȡ��Һ������ɫ��Ӧ | ����ʻ�ɫ | ԭ��Һ�к���Na+����K+ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015-2016ѧ�����ʡ��������У��һ��ѧ������������ѧ�Ծ��������棩 ���ͣ������
��1�����������ܵ������ �����ڵ���ʵ��� ��
��NaOH���� ��Һ̬SO2 ��Һ̬���� ��Һ̬������
��BaSO4 ���� ������(C12H22O11) �߰�ˮ ���ڻ���KNO3
��2����Ҫ��д�����з���ʽ��
���� ��ˮ��Ӧ�����ӷ���ʽ��
��ˮ��Ӧ�����ӷ���ʽ��
�ڽ�NaHSO4��Һ��μ��뵽Ba(OH)2��Һ�У���Ba2+ǡ�ó�����ȫʱ�����ӷ���ʽΪ��
��3���������ӷ���ʽ��д��һ�����������Ļ�ѧ����ʽ
CaO��2H+=Ca2+��H2O
��4������K2SO4��Al2(SO4)3�Ļ����Һ������K�����ʵ���Ũ����0.2mol��L��1��SO42�����ʵ���Ũ����0.7mol��L��1��������Һ��Al3�����ʵ���Ũ��Ӧ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015-2016ѧ�����ʡ�����и�һ��ѧ�����п��Ի�ѧ�Ծ��������棩 ���ͣ�ʵ����
��ͼ����ѧ��ѧ�г����ڻ����ķ�����ᴿ��װ�ã������װ�ûش����⣺

��1�����Ȼ�����Һ�еõ��Ȼ��ƹ��壬ѡ��װ�� �������װ��ͼ����ĸ����ͬ������ȥ����ˮ�е�Cl�������ʣ�ѡ��װ�� ���ӵ�ˮ �з����I2��ѡ��װ�� ���÷��뷽��������Ϊ ��
�з����I2��ѡ��װ�� ���÷��뷽��������Ϊ ��
��2��װ��A�Тٵ������� ����ȴˮ�ķ�����______________,�¶ȼ�ˮ�����λ������ ��װ��B�ڷ�Һʱװ���е�Һ�岻��˳�����£�ԭ����______________________��
��3���ӵ�ˮ�еõ���ʱ������ѡ�õ��Լ���____________
A���ƾ� B���� C�����Ȼ�̼
��ѡ���Լ�X���ܶ�С��ˮ���ܶȣ��ӵ�ˮ����ȡ��ʱ����������ú��²�Һ�����ɫΪ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015-2016ѧ���������ʦ������ѧ��һ�����л�ѧ�Ծ��������棩 ���ͣ�ѡ����
�������ʵķ����������
�� | �� | �� | ���������� | |
A | ���� | ���� | �ռ� | �������� |
B | �ռ� | ���� | ʳ�� | һ����̼ |
C | ������ | ���� | ʯ��ʯ | ˮ |
D | KOH | ̼�� | ���� | �������� |
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com