
【题目】下列说法不正确的是
A. 沸点:H2O>HFB. 热稳定性:HF>H2O
C. NCl3、SiCl4分子中每个原子最外层均满足8电子结构D. 仅由N、H、O三种元素形成的化合物中不可能含离子键
科目:高中化学 来源: 题型:
【题目】1mol乙烯与氯气发生完全加成反应,然后该加成反应的产物与足量的氯气在光照条件下发生完全取代反应,则两个过程消耗氯气的总物质的量为( )
A.3molB.4molC.5molD.6mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】厨房垃圾发酵液可通过电渗析法处理,同时得到乳酸的原理如图所示(图中HA表示乳酸分子,A-表示乳酸根离子)。下列说法正确的是

A. 通电后,阳极附近PH增大 B. 电子从负极经电解质溶液回到正极
C. 通电后,A-通过阴离子交换膜从阴极进入浓缩室 D. 当电路中通过2mol电子的电量时,会有11.2LO2生成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求回答问题
(1)KAl(SO4)2的电离方程式_______________________。
(2)向石蕊试液中通入氯气,起始时溶液变红,一段时间后溶液褪色,则使溶液变红和褪色的微粒分别是______________、_________________ (填微粒符号)。
(3)实验室用质量分数为36.5%,密度为1.19g·cm-3的浓盐酸来配制100ml,2mol/L的稀盐酸,需要用量筒量取_______________ml该浓盐酸。
(4)化学方程式H2S+H2SO4(浓)=SO2↑+S↓+2H2O,当生成4.48L(标况) SO2时,转移的电子是__________mol。
(5)下列四个图像中,横坐标表示加入物质的物质的量,纵坐标表示生成沉淀的量或产生气体的量,从A~D中选择符合各题要求的序号填人表中。
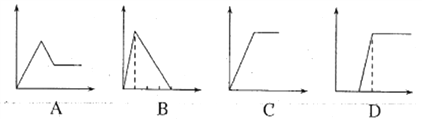
溶液 | 加入的物质 | 序号 |
①AlCl3溶液 | 通入过量的NH3 | ___ |
②Na2CO3和NaOH的溶液 | 滴入过量的盐酸 | ___ |
③NaAlO2溶液 | 滴加稀硫酸至过量 | ___ |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】草酸亚铁晶体(FeC2O4·2H2O)是一种黄色难溶于水的固体,受热易分解,是生产锂电池、涂料、着色剂以及感光材料的原材料。
Ⅰ、草酸亚铁晶体的制备:

(1)步骤①硫酸亚铁铵晶体加稀硫酸溶解的原因是___________________。
(2)步骤2倾析的作用是使固液分离,具体操作是静置后,将沉淀上部的溶液倾入另一容器,从而获得固体。倾析法与普通的过滤相比,明显的优点是____________________。
(3)硫酸亚铁铵俗称莫尔盐,在空气中比一般的亚铁盐稳定,较难被氧化,其水溶液的性质与组成它的简单盐的混合溶液没有区别。设计简单实验证明硫酸亚铁铵比硫酸亚铁更稳定______________________。
Ⅱ、测定草酸亚铁的纯度:
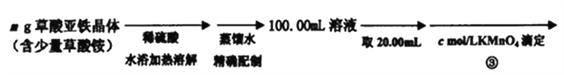
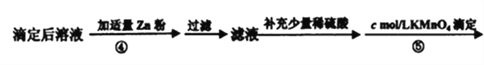
(4)在步骤③的溶液中除发生反应MnO4-+8H++5Fe2+=5Fe3++Mn2++4H2O 外,还有另一氧化还原反应,写出该反应的离子方程式__________________ ;用KmnO4标准溶液滴定至终点的现象是_____________________。
(5)步骤④加入适量锌粉的目的是________________。
(6)相同条件下,重复滴定三次,步骤③平均消耗KmnO4标准溶液V1mL,步骤⑤平均消耗V2mL,则mg固体样品的纯度计算式为______________。(用相关字母表示,不必化简)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用无机矿物资源生产部分材料,其产品流程示意图如下,下列说法正确的是( )

A. 制取粗硅时生成的气体产物为CO2
B. 生产铝、铜、高纯硅及玻璃的过程中都涉及氧化还原反应
C. 电解精炼铜时,当电路中转移0.2mol电子时阳极质量减轻6.4g
D. 粗硅制高纯硅时,提纯四氯化硅可用多次分馏的方法
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2L恒容密闭容器中,发生反应 2NO(g)+O2(g)2NO2(g). 
(1)某温度时,按物质的量比2:1充入NO和O2开始反应,n(NO)随时间变化如表:
时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)(mol) | 0.020 | 0.010 | 0.007 | 0.006 | 0.006 | 0.006 |
0~4s内以O2浓度变化表示的反应速率1~5s内以NO浓度变化表示的反应速率(选填“小于”、“大于”、“等于”).
(2)该反应的平衡常数表达式为K=.能说明该反应已达到平衡状态的是 . A.气体颜色保持不变 B.气体平均相对分子质量保持不变
C.υ逆(NO)=2υ正(O2)D.气体密度保持不变
(3)已知:K300℃>K400℃.下列措施能使该反应的反应速率增大且平衡向正反应方向移动的是 .
A.升高温度
B.充入Ar使压强增大
C.充入O2使压强增大
D.选择高效催化剂
(4)将amolNO和bmolO2发生反应,要使反应物和生成物物质的量之比为1:2,则a/b的取值范围是 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com