
制备金属氯化物,常用两种方法:①用金属与氯气直接化合得到;②用金属与盐酸反应制得。下列氯化物中既能由金属和氯气直接反应制得,又能由金属和盐酸反应制得的是
A.CuCl2 B.FeCl3 C.AlCl3 D.FeCl2
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
为了探究化学反应速率和化学反应限度的有关问题,某研究小组进行了以下实验
Ⅰ.以HCl和碳酸钙的反应为研究对象,实验方案与数据记录如下表,t表示收集a mL CO2所需的时间。
| 序号 | 反应 温度/℃ | c(HCl)/ mol·L-1 | V(HCl) /mL | 10g碳酸钙的形状 | t/min |
| 1 | 20 | 2 | 10 | 块状 | t1 |
| 2 | 20 | 2 | 10 | 粉末 | t2 |
| 3 | 20 | 4 | 10 | 粉末 | t3 |
| 4 | 40 | 2 | 10 | 粉末 | t4 |
(1)设计实验1和实验2的目的是研究________________________对化学反应速率的影响。
(2)为研究温度对化学反应速率的影响,可以将实验________和实验________(填序号)作对比。
(3)将实验2和实验3作对比,t2________t3(填“>”、“<”或“=”)。
Ⅱ.以KI和FeCl3反应为例(2Fe3++2I-===2Fe2++I2)设计实验,探究此反应存在一定的限度。可选试剂:
① 0.1 mol·L-1 KI溶液
② 0.1 mol·L-1 FeCl3溶液
③ 0.1 mol·L-1 FeCl2溶液
④ 0.1 mol·L-1 盐酸
⑤ 0.1 mol·L-1 KSCN溶液
⑥CCl4
实验步骤:(1)取5 mL 0.1 mol·L-1 KI溶液,再滴加几滴0.1 mol·L-1 FeCl3溶液
(2)充分反应后,将溶液分成三份
(3)取其中一份,加试剂⑥,振荡,CCl4层显紫色,说明反应生成碘
(4)另取一份,加试剂________(填序号),现象________________________,说明此反应存在一定的限度。
Ⅲ.N2O4可分解为NO2。在200 mL密闭容器中投入0.02 mol N2O4,利用现代化学实验技术跟踪测量c(NO2)。c(NO2)随时间变化的数据记录如下图所示。
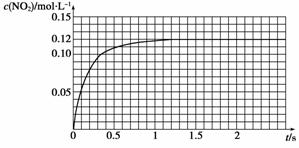
反应容器中最后剩余的物质有________________,其中N2O4的物质的量为________mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
偏二甲肼与N2O4 是常用的火箭推进剂,二者发生如下化学反应:
(CH3)2NNH2 (l )+2N2O4 (l )=2CO2 (g )+3N2 (g )+4H2O (l ) (Ⅰ)
(1)若将反应(Ⅰ)设计成原电池,则正极的电极反应式为
(酸性电解质)。
(2)火箭残骸中常现红棕色气体,原因为:N2O4 (g)  2NO2 (g) (Ⅱ)
2NO2 (g) (Ⅱ)
当温度升高时,气体颜色变深,则反应(Ⅱ)为 (填“吸热”或“放热”)反应。
(3)一定温度下,反应(Ⅱ)的焓变为ΔH。现将1 mol N2O4 充入一恒压密闭容器中,
下列示意图正确且能说明反应达到平衡状态的是________.
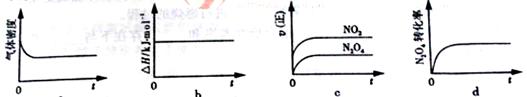
若在相同温度下,上述反应改在体积为1L的恒容密闭容器中进行,平衡常数________(填“增大”“不变”或“减小”),反应3s后NO2的物质的量为0.6mol,则0~3s内的平均反应速率v(N2O4)=________mol·L-1·s-1。
(4)NO2可用氨水吸收生成NH4NO3 。25℃时,将amol NH4NO3溶于水,溶液显酸性,原因是_____ (用离子方程式表示)。向该溶液滴加bL氨水后溶液呈中性,则滴加氨水的过程中的水的电离平衡将______(填“正向”“不”或
“逆向”)移动,所滴加氨水的浓度为_______mol·L-1。(NH3·H2O的电离平衡常数
Kb=2×10—5 mol·L-1)
查看答案和解析>>
科目:高中化学 来源: 题型:
研究物质性质的基本程序是一个系统过程,其基本程序一般分为四个过程。下列是研究物质性质基本程序的第一步的是
A.预测物质的性质 B.观察物质的外观性质
C.进行实验和观察 D.作出相关的解释和结论
查看答案和解析>>
科目:高中化学 来源: 题型:
将4.0 g NaOH固体溶于水配成100mL溶液,其密度为
0.20g/mL。
(1)该溶液中NaOH 的物质的量浓度为
(2)该溶液中NaOH的质量分数为
(3)从该溶液中取出10mL,其中NaOH的物质的量浓度为 ,含NaOH的质量为 。
(4)将取出的10mL溶液加水稀释到100mL,稀释后溶液中NaOH的物质的量浓度为
。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列实验操作正确的是 ( )
A.少量浓硫酸沾在皮肤上,立即用氢氧化钠溶液冲洗
B.在食盐溶液蒸发结晶的过程中,当蒸发皿中出现较多量固体时即停止加热
C.先在天平两个托盘上各放一张相同质量的纸,再把氢氧化钠固体放在纸上称量
D.过滤时,慢慢地将液体直接倒入过滤器中
查看答案和解析>>
科目:高中化学 来源: 题型:
选择下列实验方法分离物质,将分离方法的序号填在横线上。
A、加热分解 B、结晶法 C、分液法 D、蒸馏法 E、过滤法
(1)___________分离饱和食盐水和沙子的混合物
(2)___________从硝酸钾和氯化钠的混合溶液中获得硝酸钾(溶解度差异很大)
(3)___________分离水和汽油的混合物
(4)___________分离四氯化碳(沸点为76.75°C)和甲苯(沸点为110.6°C)
查看答案和解析>>
科目:高中化学 来源: 题型:
原子序数依次增大的短周期元素a、b、c、d和e中,a的最外层电子数为其周期数的二倍;b和d的A2B型氢化物均为V形分子,c的+1价离子比e的-1价离子少8个电子。
回答下列问题:
(1)元素a为________;c为________;
(2)由这些元素形成的双原子分子为________;
(3)由这些元素形成的三原子分子中,分子的空间结构属于直线形的是________,非直线形的是______________;(写2种)
(4)这些元素的单质或由它们形成的AB型化合物中,其晶体类型属于原子晶体的是________,离子晶体的是________,金属晶体的是________,分子晶体的是________;(每空填一种)
(5)元素a和b形成的一种化合物与c和b形成的一种化合物发生的反应常用于防毒面具中,该反应的化学方程式为_______________ _________________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com