
【题目】将纯铁片和纯铜片按下图所示插入同浓度的稀硫酸中一段时间,下列叙述正确的是
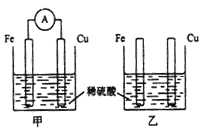
A. 甲装置中电能转化为化学能
B. 两个装置中铜片表面均有气泡产生
C. 甲装置中H+移向铜片发生还原反应
D. 甲中负极上发生的电极反应为Fe-3e-=Fe3+
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】(1)某温度(t ℃)时,水的KW=1×10-13,则该温度(填“大于”、“小于”或“等于”)__ __________25 ℃,其理由是____________。将此温度下pH=11的NaOH溶液a L与pH=1的H2SO4的溶液b L混合,若所得混合液为中性,则a∶b=____________。
(2)已知25 ℃时0.1 mol/L醋酸溶液达到平衡(HAc![]() H++Ac-)时的pH约为3,如果在此溶液中加入等体积的pH为5的盐酸,则电离平衡____________移动(填“向左”、“向右”或“不”);若向原醋酸溶液中加入少量醋酸钠晶体,待晶体溶解后溶液的pH值____________(填“增大”、“减小”或“不变”)。
H++Ac-)时的pH约为3,如果在此溶液中加入等体积的pH为5的盐酸,则电离平衡____________移动(填“向左”、“向右”或“不”);若向原醋酸溶液中加入少量醋酸钠晶体,待晶体溶解后溶液的pH值____________(填“增大”、“减小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Q、R、T、M、W五种短周期元素在周期表中的相对位置如图所示,其中M的原子序数是R的原子序数的2倍。下列说法正确的是( )
![]()
A. MW6中各原子核外均满足8电子稳定结构
B. Q、W的单核离子的核外电子数相等
C. 五种元素均能形成氢化物
D. W的氢化物水溶液酸性最强,说明W的非金属性在五种元素中最强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知在298K和101kPa条件下,有如下反应:
反应Ⅰ:C(s) + O2(g) = CO2(g) △ H1=-393.5 kJ·mol-1
反应Ⅱ:2C(s) + O2(g) = 2CO(g) △ H2=-221 kJ·mol-1
反应Ⅲ:N2(g) + O2(g) = 2NO(g) △ H3=+180.5 kJ·mol-1
试回答下列问题:
(1)汽车尾气净化原理为反应Ⅳ:2NO(g) + 2CO(g) ![]() N2(g) + 2CO2(g) △ H=______,该反应能自发进行的条件是_______。(填“高温”、“低温”或“任意温度”)。
N2(g) + 2CO2(g) △ H=______,该反应能自发进行的条件是_______。(填“高温”、“低温”或“任意温度”)。
(2)如果在一定温度下,体积为 2 升的密闭容器中发生化学反应Ⅳ,0~4min各物质物质的量的变化如下表所示:
物质(mol) 时间 | NO | CO | N2 | CO2 |
起始 | 0.40 | 1.0 | ||
2 min 末 | 2.0 | 0.80 | 1.6 | |
4 min 末 | 1.6 |
①求 0~2min 内用 CO 来表示的平均反应速率 v(CO)=________。
②试计算该温度下反应Ⅳ 的化学平衡常数 K=_________。
(3)若一定温度下,在容积可变的密闭容器中,上述反应Ⅳ达到平衡状态,此时容积为3L, c(N2)随时间 t 的变化曲线 x 如图所示。
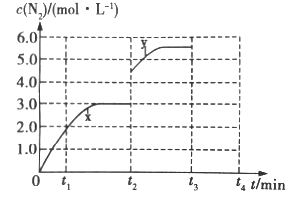
①若在 t2min时改变一个条件,c(N2)随反应时间 t 的变化如曲线 y 所示,则改变的条件是______。
②若在t2min时升高温度,t3min时重新达到平衡,请在图中画出在 t2~t4 内 c(N2)的变化曲线______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高温条件下,Al和Fe3O4反应生成Fe和Al2O3。下列说法正确的是

A. 该反应过程中的能量变化如图所示
B. 该反应条件下,Al的还原性弱于Fe
C. 1molFe3O4参与反应转移8×6.02×1023个电子
D. 实验室进行该反应时常加入KClO3作催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在无色透明的碱性溶液中能大量共存的离子组是
A.K+ 、Cu2+、Na+、Cl-
B.K+、Na+、NO3-、CO32-
C.Na+、H+、NO3-、SO42-
D.Fe3+、Na+、Cl-、SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液含有①NO3-、②HCO3-、③SO32-、④CO32-、⑤SO42-五种阴离子。现向其中加入少量的Na2O2固体后,溶液中离子浓度增大的是(设溶液体积无变化)( )
A. ① B. ④ C. ①④⑤ D. ④⑤
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com