
【题目】(1)配制480 mL 0.1 mol/L CuSO4溶液,需要称量CuSO4·5H2O ________g。
(2)取200 mLNa2CO3和Na2SO4的混合溶液,加入过量BaCl2溶液后得到29.02 g白色沉淀,用过量稀盐酸处理后沉淀量减少到9.32 g,并有气体放出。原混合溶液中Na2SO4的物质的量浓度为________mol·L-1;产生的气体在标准状况下的体积为________L。
(3)在实验室将8.4g固体NaHCO3加热一段时间后,测得剩余固体的质量变为6.85g.则有______ g NaHCO3固体发生了分解反应。若继续对剩余固体加热,至不再产生气体后,将冷却后的固体溶解于水,配成1000mL的溶液.则该溶液溶质的物质的量浓度是____________。
(4)向VL AlCl3和FeCl3混合溶液中加入含a mol NaOH的溶液时,产生的沉淀量可达最大值,继续加入NaOH溶液,沉淀开始溶解,当前后加入的NaOH总量达到b mol时,沉淀不再减少,则原溶液中Fe3+的物质的量浓度为________。
【答案】12.5 0.2 2.24 4.2 0.05mol/L [(4a/3-b)/V]mol/L
【解析】
(1)根据m=cVM计算胆矾的质量。
(2)Na2CO3和Na2SO4的混合溶液中加入过量BaCl2溶液后产生的白色沉淀是碳酸钡和硫酸钡,加入盐酸后碳酸钡溶解,硫酸钡不溶,结合反应的方程式分析解答。
(3)发生反应为2NaHCO3![]() Na2CO3+CO2↑+H2O,利用差量法计算出分解的碳酸氢钠的质量;最终得到的固体为碳酸钠,根据Na元素守恒计算出所得溶液的浓度;
Na2CO3+CO2↑+H2O,利用差量法计算出分解的碳酸氢钠的质量;最终得到的固体为碳酸钠,根据Na元素守恒计算出所得溶液的浓度;
(4)沉淀量由最大到不再减少,减少的是氢氧化铝,结合方程式利用氢氧化钠的物质的量求出氢氧化铝的物质的量,根据氢氧化铝的物质的量求出生成氢氧化铝所用NaOH的物质的量,产生的沉淀量达最大值时使用的氢氧化钠的物质的量减去生成氢氧化铝所用NaOH的物质的量,就是生成氢氧化铁时使用的氢氧化钠的物质的量,再根据方程式求出FeCl3的物质的量,根据物质的量浓度浓度公式求出浓度即可。
(1)配制480 mL 0.1 mol/L CuSO4溶液需要500mL容量瓶,需要称量CuSO4·5H2O的质量为0.5L×0.1mol/L×250g/mol=12.5g。
(2)取200 mLNa2CO3和Na2SO4的混合溶液,加入过量BaCl2溶液后得到29.02 g白色沉淀,用过量稀盐酸处理后沉淀量减少到9.32 g,剩余的是硫酸钡,物质的量是9.32g÷233g/mol=0.04mol,根据硫酸根守恒可知原混合溶液中Na2SO4的物质的量是0.04mol,浓度为0.04mol÷0.2L=0.2mol·L-1;碳酸钡的质量是29.02g-9.32g=19.7g,物质的量是19.7g÷197g/mol=0.1mol,根据碳原子守恒可知产生的气体在标准状况下的体积为0.1mol×22.4L/mol=2.24L。
(3)2NaHCO3![]() Na2CO3+CO2↑+H2O 固体质量减少
Na2CO3+CO2↑+H2O 固体质量减少
168 106 62
4.2g 8.4g-6.85g
因此有4.2 g NaHCO3固体发生了分解反应。
根据反应可知,最终得到的固体为碳酸钠,碳酸氢钠的物质的量是0.1mol,则所得溶液中碳酸钠的物质的量为0.1mol÷2=0.05mol。将冷却后的固体溶解于水,配成1000mL的溶液,则该溶液溶质的物质的量浓度是0.05mol÷1L=0.05mol/L。
(4)开始产生沉淀至沉淀量达最大值发生反应:FeCl3+3NaOH=Fe(OH)3↓+3NaCl、AlCl3+3NaOH=Al(OH)3↓+3NaCl。继续加入NaOH溶液,沉淀开始溶解至沉淀完全不再减少发生反应:Al(OH)3+NaOH=NaAlO2+2H2O。沉淀开始溶解至沉淀完全不再减少,消耗NaOH的物质的量为(b-a)mol,Al(OH)3与NaOH发生反应的物质的量之比是1:1,所以Al(OH)3的物质的量是(b-a)mol;根据方程式AlCl3+3NaOH=Al(OH)3↓+3NaCl,当有(b-a)mol Al(OH)3生成时,需要NaOH的物质的量是Al(OH)3的3倍,所以需要NaOH的物质的量是3(b-a)mol;则与氯化铁反应的NaOH的物质的量为amol-3(b-a)mol=(4a-3b)mol,根据反应方程式FeCl3+3NaOH=Fe(OH)3↓+3NaCl知,生成Fe(OH)3所用NaOH物质的量是FeCl3的3倍,所以FeCl3物质的量是(4a/3-b)mol,因为溶液的体积是VL,所以FeCl3的物质的量浓度是[(4a/3-b)/V]mol/L。


科目:高中化学 来源: 题型:
【题目】关于同分异构体的下列说法中正确的是
A. 结构不同,性质相同,化学式相同的物质互称同分异构体
B. 同分异构体现象是导致有机物数目众多的重要原因之一
C. 同分异构体现象只存在于有机化合物中
D. 同分异构体现象只存在于无机化合物中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】若用AG表示溶液的酸度,其表达式为:AG=lgc(H+)/c(OH-)。室温下,实验室里用0.1mol/L的盐酸溶液滴定10mL0.1mol/LMOH溶液,滴定曲线如下图所示。下列说法正确的是

A. 该流定过程可选择酚酞作为指示剂
B. 溶液中由水电离的c(H+):C点>D点
C. C点时加入盐酸溶液的体积等于10mL
D. 若B点加入的盐酸溶液体积为5mL,所得榕液中:c(M+)+c(H+)=c(MOH)+c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用FeCl3溶液腐蚀印刷电路板上铜箔的反应是:2Fe3++Cu = 2Fe2++ Cu2+。下列有关说法错误的是( )
A.Cu是还原剂,被腐蚀
B.Fe3+是氧化剂
C.该反应是置换反应
D.该反应属于离子反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值,下列叙述正确的是( S-32 O-16 ) ( )
A.标准状况下,22.4L氦气含有2NA个氦原子
B.在常温常压下,11.2L Cl2含有的分子数为0.5NA
C.常温常压下,64g SO2中含有的氧原子数为2NA
D.标准状况下,11.2LH2O含有的分子数为0.5NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“稀土”是我国宝贵的战略资源。已知稀土元素钐(Sm)的原子序数是62,Sm的某种同位素中子数是82,其质量数是( )
A.144B.82C.62D.20
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中只含有Ba2+ Mg2+ Ag+三种阳离子,现用适量的NaOH溶液、稀盐酸和Na2SO4溶液将这三种离子逐一沉淀分离,其流程如图所示:
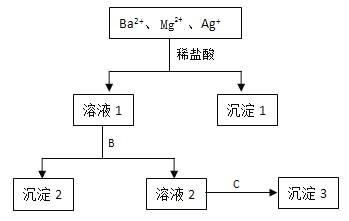
(1)沉淀1的化学式为 ,生成该沉淀的离子方程式为 。
(2)若试剂B为Na2SO4溶液,则沉淀2化学式为 。
(3)若试剂B为NaOH溶液,则生成沉淀2的离子方程式为 。
(4)如果原溶液中Ba2+ Mg2+ Ag+的浓度均为0.1 mol·L-1,且溶液中含有的阴离子只有NO3-,则溶液中NO3- 浓度为 mol·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“低碳生活”是指改善环境、减少能源消耗、节约资源、减少二氧化碳排放的健康生活方式.下列不符合“低碳生活”的做法是( )
A.“垃圾不落地,台州更美丽”
B.太阳能热水器代替燃气热水器
C.杜绝使用一切燃料
D.环保袋代替一次性塑料袋
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com