
【题目】某校化学趣小组设计了图示实验装置来测定某铁碳合金的质量分数。

完成下列填空:
(1)m g铁碳合金中加入过量浓硫酸,未点燃酒精灯前,A、B均无明显现象,其原因是:①常温下碳与浓硫酸不反应;②______________________________________。
(2)加热时A中碳与浓硫酸反应的化学方程式为____________,B中的现象是__________;C的作用是______________________________。
(3)待A中不再逸出气体时,停止加热,拆下E并称重,E称重b g。则铁碳合金中铁的质量分数的表达式为______________________________(化简后的表达式)。
(4)甲同学认为利用此装置测得铁的质量分数偏大,可能的原因是__________________。
(5)乙同学提出,本套装置在设计上存在多处缺陷而导致实验结果不准确,其中会导致铁质量质量分数测量值偏低是___________(回答一条即可)。
【答案】常温下铁遇浓硫酸发生“钝化” C+2H2SO4(浓)![]() CO2↑+2SO2↑+2H2O 品红溶液褪色 检验SO2是否除尽
CO2↑+2SO2↑+2H2O 品红溶液褪色 检验SO2是否除尽 ![]() 装置中残留的CO2未被E吸收 E中碱石灰会吸收空气中的CO2、H2O等
装置中残留的CO2未被E吸收 E中碱石灰会吸收空气中的CO2、H2O等
【解析】
由装置图可知,该实验原理:通过测定干燥管E的质量增重确定二氧化碳的质量,根据二氧化碳的质量计算铁碳合金中碳的质量,进而计算铁的质量,再计算合金中铁的质量分数.故二氧化硫会影响二氧化碳的测定,进入干燥管E的气体应除去二氧化硫、且干燥.装置A:碳和浓硫酸反应,装置B:检验二氧化硫,装置C:除去二氧化硫,装置D:干燥二氧化碳,装置E:吸收二氧化碳。
(1)常温下碳与浓硫酸不反应,铁在浓硫酸中发生钝化现象;
(2)碳与浓硫酸在加热的条件下生成二氧化硫、二氧化碳、水;
A中生成的气体含有CO2、2SO2,SO2具有漂白性,能使品红溶液褪色;
二氧化硫存在会影响二氧化碳的质量测定,C装置的作用为除尽反应产物中的SO2气体;(3)E增重bg为二氧化碳的质量,根据碳元素守恒计算合金中碳元素的质量,合金的质量减去碳元素质量等于铁的质量,再根据质量分数定义计算;
(4)装置内残留部分二氧化碳,未能被装置E完全吸收,导致测量的二氧化碳的质量偏小,即合金中碳元素的质量偏小;
(5)由装置图可知,SO2不一定能全部被品红KMnO4除去,E中碱石灰会吸收空气中的CO2、H2O等。
(1)常温下,铁与浓硫酸反应生成一层致密的氧化物保护膜,阻止内金属继续与浓硫酸反应,发生钝化现象,
故答案为:常温下铁遇浓硫酸发生“钝化”;
(2)碳与浓硫酸在加热的条件下生成二氧化硫、二氧化碳、水,反应的化学方程式为:C+2H2SO4(浓)![]() CO2↑+2SO2↑+2H2O,A中生成的气体含有CO2、2SO2,SO2具有漂白性,能使品红溶液褪色;C装置的作用为除尽反应产物中的SO2气体,防止影响二氧化碳的质量测定,
CO2↑+2SO2↑+2H2O,A中生成的气体含有CO2、2SO2,SO2具有漂白性,能使品红溶液褪色;C装置的作用为除尽反应产物中的SO2气体,防止影响二氧化碳的质量测定,
故答案为:C+2H2SO4(浓)![]() CO2↑+2SO2↑+2H2O;品红溶液褪色;检验SO2是否除尽;
CO2↑+2SO2↑+2H2O;品红溶液褪色;检验SO2是否除尽;
(3)E增重b g为二氧化碳的质量,根据碳元素守恒可知
合金中碳元素的质量为![]() ,
,
合金中铁的质量为![]() ,
,
故铁的质量分数![]() ,
,
故答案为:![]() ;
;
(4)装置内残留部分二氧化碳,未能被装置E完全吸收,导致测量的二氧化碳的质量偏小,即合金中碳元素的质量偏小,铁元素的质量增大,质量分数增大,
故答案为:装置中残留的CO2未被E吸收;
(5)由装置图可知,SO2不一定能全部被品红KMnO4除去,E中碱石灰会吸收空气中的CO2、H2O等,
故答案为:E中碱石灰会吸收空气中的CO2、H2O等。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】A是石油裂解气的主要成分之一,以A为原料制备药物中间体X的合成路线如下:

已知i.
ii.![]() 。
。
回答下列同题:
(1)A的结构简式为_________,B的名称为__________,D中含有的官能团的名称是___________。
(2)有机物I的结构简式为___________;反应④的反应类型是___________。
(3)由A生成B的化学方程式为______________________________________。
(4)反应⑧的化学方程式为___________________________________________。
(5)满足以下条件的X的同分异构体有___________种。
i.能发生银镜反应;
ii.含有六元环结构;
iii.六元环上有2个取代基。
其中核磁共振氢谱中有6组峰,且峰面积之比为4:4:3:2:2:1的有机物的结构简式为________(任写一种)。
(6)参照F的合成路线,以CH3CH=CHCH3为原料设计制备 的合成路线:__________(其他试剂任选)。
的合成路线:__________(其他试剂任选)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从元素化合价升降的角度分析,下列不属于氧化还原反应的是
A. H2+Cl2![]() 2HCl B. 2HClO
2HCl B. 2HClO![]() 2HCl+O2
2HCl+O2
C. 2NaI+Br2=2NaBr+I2 D. CaCl2+Na2CO3=CaCO3↓+2NaCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图表示某可逆反应在使用和未使用催化剂时,反应过程和能量的对应关系。下列说法一定正确的是
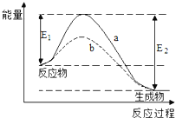
A. 该反应为吸热反应
B. a与b相比,a的反应速率更快
C. a与b相比,反应的平衡常数一定不同
D. 反应物吸收的总能量小于生成物释放的总能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:H2(g)+I2(g)![]() 2HI(g)△H=-14.9kJ·mol-1。某温度下,在体积均为2.0L的甲、乙两个恒容密闭容器中充入反应物,其起始物质的量如下表所示。甲中反应达到平衡时,测得c(H2)=0.008mol·L-1。下列判断正确的是( )
2HI(g)△H=-14.9kJ·mol-1。某温度下,在体积均为2.0L的甲、乙两个恒容密闭容器中充入反应物,其起始物质的量如下表所示。甲中反应达到平衡时,测得c(H2)=0.008mol·L-1。下列判断正确的是( )
起始物质的量 | n(H2)/mol | n(I2)/mol | n(HI)/mol |
甲 | 0.02 | 0.02 | 0 |
乙 | 0.04 | 0.04 | 0 |
A. 平衡时,乙中H2的转化率是甲中的2倍
B. 平衡时,甲中混合物的颜色比乙中深
C. 平衡时,甲、乙中热量的变化值相等
D. 该温度下,反应的平衡常数K=0.25
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究金属腐蚀和防腐的原理很有现实意义。
(1)甲图为人教版教材中探究钢铁的吸氧腐蚀的装置。某兴趣小组按该装置实验,导管中液柱的上升缓慢,下列措施可以更快更清晰观察到水柱上升现象的有________(填序号)。

A.用纯氧气代替试管内空气 B.用酒精灯加热试管提高温度
C.将铁钉换成铁粉和炭粉混合粉末 D.换成更细的导管,水中滴加红墨水
(2)该小组将甲图装置改进成乙图装置并进行实验,导管中红墨水液柱高度随时间的变化如下表,根据数据判断腐蚀的速率随时间逐渐_______________(填“加快”、“不变”、“减慢”), 你认为影响因素为________________________________________
时间/min | 1 | 3 | 5 | 7 | 9 |
液柱高度/cm | 0.8 | 2.1 | 3.0 | 3.7 | 4.2 |
(3)为探究铁钉腐蚀实验 a、b 两点所发生的反应,进行以下实验,请完成表格空白:
实验操作 | 实验现象 | 实验结论 |
向 NaCl溶液中滴加 2~3 滴酚酞指示剂 | a 点附近溶液出现红色 | a 点电极反应为①___________________ |
然后再滴加 2~3 滴②________________ | b 点周围出现蓝色沉淀 | b 点电极反应为③___________________ |
根据以上实验探究,试判断____________(填“a”或“b”)为负极,该点腐蚀更严重。
(4)设计下面装置研究弱酸性环境中腐蚀的主要形式。测定锥形瓶内气压和空气中氧气的体积分数随时间变化见下图,从图中可分析,t1~t2 之间主要发生__________ 腐蚀(填吸氧或析氢),原因是__________________________________________。

(5)金属阳极钝化是一种电化学防腐方法。将 Fe 作阳极置于 H2SO4 溶液中,一定条件下Fe 钝化形成致密 Fe3O4 氧化膜,试写出该阳极电极反应式________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是
A. 铁与稀盐酸反应:2Fe+6H+=2Fe3++3H2↑
B. 一水合氨的电离:NH3·H2O=NH4++OH-
C. 食醋除去水垢中的碳酸钙:CaCO3+2H+=Ca2++CO2↑+H2O
D. 氯气与氢氧化钠溶液反应:Cl2+2OH- =Cl-+ClO-+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在某一温度下,某一密闭容器中,M、N、R三种气体浓度的变化如图a所示,若其它条件不变,当温度分别为T1和T2时,N的体积分数与时间关系如图b所示.则下列结论正确的是( )

A.该反应的热化学方程式![]() △H>0
△H>0
B.达到平衡后,若其他条件不变,减小容器体积,平衡向逆反应方向移动
C.达到平衡后,若其它条件不变,升高温度,正、逆反应速度均增大,M的转化率减小
D.达到平衡后,若其他条件不变,通入稀有气体,平衡一定向正反应方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】被称之为“软电池”的纸质电池,其电池总反应为Zn+2MnO2+H2O![]() ZnO+2MnO(OH)。下列说法正确的是( )
ZnO+2MnO(OH)。下列说法正确的是( )
A.该电池的正极为锌
B.该电池反应中二氧化锰起催化剂作用
C.当65 g Zn完全溶解时,流经电极的电子为1mol
D.电池正极反应式为2MnO2+2e-+2H2O![]() 2MnO(OH)+2OH-
2MnO(OH)+2OH-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com