
【题目】铜粉加入稀硫酸中不溶解,再加入下列固体粉末:①FeCl2 ②Fe2O3 ③Zn ④KNO3,铜粉可溶解的是( )
A. ①② B. ②④ C. ②③ D. ①④
科目:高中化学 来源: 题型:
【题目】利用反应2Cu+O2+2H2SO4=2CuSO4+2H2O可制备CuSO4,若将该反应设计为原电池。
(1)负极材料是_______(写名称),电极反应式为________。
(2)正极电极反应式为_____________
(3)溶液中SO42-向______极移动。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
锂一磷酸氧铜电池正极的的活性物质是Cu4O(PO4)2,可通过下列反应制备:
2Na3PO4+CuSO4+2NH3·H2O= Cu4O(PO4)2↓+3Na2SO4+(NH4)2SO4+H2O
(1)写出基态Cu2+的电子排布式:_______________。
(2)PO43-的空间构型是___________________。
(3)P、S元素第一电离能大小关系为_____________________。
(4)氨基乙酸铜分子结构如图,碳原子的杂化方式为_____________,基态碳原子核外电子有
个空间运动状态。

(5)在硫酸铜溶液中加入过量KCN,生成配合物[Cu(CN)4]2-,则1 mol该配合物含有的π键的数目
为____________________。
(6)铜晶体密堆积方式如图所示,铜原子的配位数为_______________,铜的原子半径为127.8pm,NA表示阿伏伽德罗常数的值,列出晶体铜的密度计算式________________g·cm-3

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】焦亚硫酸钠(Na2S2O5)是常用的食品抗氧化剂之一。某研究小组进行如下实验:
实验一 焦亚硫酸钠的制取
采用如图装置(实验前已除尽装置内的空气)制取Na2S2O5。装置Ⅱ中有Na2S2O5晶体析出,发生的反应为:Na2SO3+SO2=Na2S2O5

(1)装置I中产生气体的化学方程式为__________________。
(2)要从装置Ⅱ中获得已析出的晶体,可采取的分离方法是_________。
(3)装置Ⅲ用于处理尾气,可选用的最合理装置(夹持仪器已略去)为________(填序号)。

实验二 焦亚硫酸钠的性质
Na2S2O5溶于水即生成NaHSO3。
(4)证明NaHSO3溶液中HSO3-的电离程度大于水解程度,可采用的实验方法是________(填序号)。
a.测定溶液的pH b.加入Ba(OH)2溶液 c.加入盐酸
d.加入品红溶液 e.用蓝色石蕊试纸检测
(5)检验Na2S2O5晶体在空气中已被氧化的实验方案是____________。
实验三 葡萄酒中抗氧化剂残留量的测定
(6)葡萄酒常用Na2S2O5作抗氧化剂。测定某葡萄酒中抗氧化剂的残留量(以游离SO2计算)的方案如下:

(已知:滴定时反应的化学方程式为SO2+I2+2H2O=H2SO4+2HI)
①按上述方案实验,消耗标准I2溶液25.00 mL,该次实验测得样品中抗氧化剂的残留量(以游离SO2计算)为________________g·L-1。
②在上述实验过程中,若有部分HI被空气氧化,则测得结果____(填“偏高”“偏低”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】丁香醛是常用的一种食用香精。存在下列转化关系:
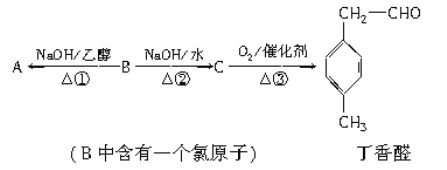
(1)B的分子式为________,C中含氧官能团的名称为________。
(2)反应②的化学方程式为____________________________________。
(3)A发生加聚反应所得产物的结构简式为________________。
(4)与A含有相同官能团的芳香族化合物的同分异构体还有________种(不考虑顺反异构),其中只有一个取代基且不含甲基的物质的结构简式为________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物的相对分子质量为102。
(1)经测定,该有机物含碳、氢、氧三种元素,其中含氢的质量分数为9.8%,分子中氢原子个数为氧原子的5倍。该有机物的分子式是________;若该有机物无甲基、无醚键,且能发生银镜反应,则该有机物的官能团的名称________________,写出该有机物与新制的氢氧化铜的反应的化学方程式:________________________________________________。
(2)经红外光谱测定,该有机物分子中含有一个羧基、一个羟基和一个碳碳双键,则其可能的结构简式为_____________________________________________________(提示:羟基不能连在碳碳双键上)。
(3)经测定,该有机物只含碳、氢两种元素,且所有原子均在同一平面,请写出该有机物的结构简式:__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于碱金属元素的说法中正确的是
A. IA族元素都是碱金属元素
B. 碱金属单质可将铜从其盐溶液中置换出来
C. 金属钾具有强还原性,K+具有强氧化性
D. Cs常温下与水反应会发生爆炸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于糖类、油脂和蛋白质的性质说法正确的是( )
A. 糖类物质中含C、H、O元素,都有甜味
B. 向淀粉溶液中加入碘水,溶液变蓝
C. 油脂是高分子化合物,热值较大
D. 在蛋白质溶液中加入浓硫酸并微热,可使蛋白质变黄
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图为实验室某浓盐酸试剂瓶标签上的有关数据,试根据标签上的有关数据回答下列问题:

(1)浓盐酸中HCl的物质的量浓度为______________mol·L-1 。
(2)取用任意体积的该盐酸溶液时,下列物理量中不随所取体积的多少 而变化的是(_______)。
A、溶液中HCl的物质的量 B、溶液的浓度
C、溶液中Cl-的数目 D、溶液的密度
(3)某学生欲用上述浓盐酸和蒸馏水配制500 mL 物质的量浓度为0.400mol·L-1的稀盐酸。
①学生需要量取_______mL上述浓盐酸进行配制。
②在配制过程中,下列实验操作对所配制的稀盐酸的物质的量浓度有何影响?
(在括号内填A表示“偏大”、填B表示“偏小”、填C表示“无影响”)。
I、定容时俯视观察凹液面(________)
II、定容后经振荡、摇匀、静置,发现液面下降,再加适量的蒸馏水(________)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com