
| A. | 乙醇和汽油都是可再生能源,应大力推广使用乙醇汽油 | |
| B. | 凡含有食品添加剂的食物对人体健康均有害,不宜食用 | |
| C. | PM2.5主要来自于煤和石油等化石燃料的燃烧 | |
| D. | 汽车尾气中的一氧化氮遇空气在低温下能自发进行反应,说明该反应的△H>O |
分析 A.汽油来自于石油,是不可再生资源;
B.按照食品法规定的符合添加剂标准的食物对人体健康无害;
C.化石燃料(煤、石油、天然气)的燃烧产生扬尘;
D.根据当△G=△H-T•△S<0时,反应能自发进行.
解答 解:A.乙醇是可再生能源,但汽油不是,乙醇汽油是一种由粮食及各种植物纤维加工成的燃料乙醇和普通汽油按一定比例混配形成的新型替代能源,故A错误;
B.合理使用食品添加剂,对丰富食品生产,且对人体健康无害,可以食用,但不能过量,故B错误;
C.PM2.5主要来自于化石燃料(煤、石油、天然气)的燃烧和扬尘,故C正确;
D.当△G=△H-T•△S<0时,反应能自发进行,一氧化氮遇空气在低温下能自发进行反应,已知2NO+O2=2NO2,该反应的△S<0,说明该反应的△H<O,故D错误.
故选C.
点评 本题考查可再生资源、食品添加剂的使用、环境污染等知识,难度不大,注意汽油来自于石油是解题的关键.


科目:高中化学 来源: 题型:选择题
| A. | 酸性:HClO4<HBrO4<HIO4 | B. | 稳定性:HF<HCl<HBr<HI | ||
| C. | 与H2反应由易到难:F2>Cl2>Br2>I2 | D. | 还原性:HF>HCl>HBr>HI |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
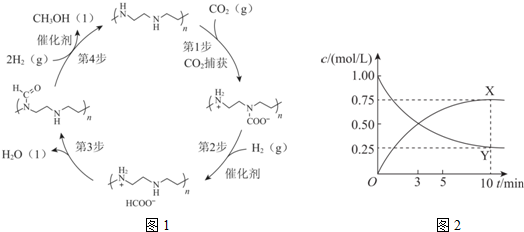
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
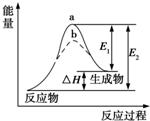
| A. | 该反应为吸热反应,△H=E1-E2 | |
| B. | 使用催化剂,△H减小 | |
| C. | 使用催化剂,可以改变化学平衡常数 | |
| D. | 如图可知b使用了催化剂,反应速率加快 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢氟酸存放在带有橡胶塞的棕色玻璃瓶中 | |
| B. | 溴水存放在带橡胶塞的试剂瓶中 | |
| C. | 浓硝酸保存在磨口玻璃塞棕色试剂瓶中,并置于阴凉处 | |
| D. | 氢氧化钠溶液保存在磨口玻璃塞的试剂瓶中 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com