
【题目】实验室中某些气体的制取、收集及尾气处理装置如图所示![]() 省略夹持和净化装置
省略夹持和净化装置![]() 仅用此装置和表中提供的物质完成相关实验,最合理的选项是
仅用此装置和表中提供的物质完成相关实验,最合理的选项是
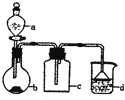
选项 | a中的物质 | b中的物质 | c中的物质 | d中的物质 |
A | 浓氨水 | NaOH |
|
|
B | 浓盐酸 |
|
| NaOH溶液 |
C | 稀硝酸 | Cu | NO |
|
D | 浓硫酸 |
|
| NaOH溶液 |
A.AB.BC.CD.D
科目:高中化学 来源: 题型:
【题目】铋及其化合物在工业生产中用途广泛,某研究小组用浮选过的辉铋矿(主要成分是Bi2S3,还含少量Bi2O3、SiO2等杂质)制备铋酸钠,其流程如下:
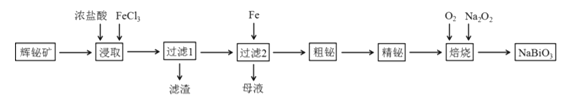
已知:①铋酸钠是一种难溶于水的物质;②水解能力:Bi3+>Fe3+。
回答下列问题:(1)“浸取”时,为了提高浸取速率,可采取的措施有______(任写一条);过滤1的滤渣中的某种主要成分可溶于一种弱酸,写出该反应的化学方程式______。
(2)浸取时加入过量浓盐酸的目的是______;“母液”中通入气体X后可循环利用,气体X为______(填名称)。
(3)写出焙烧时生成铋酸钠的化学方程式______。
(4)用![]() 双硫腙,二元弱酸
双硫腙,二元弱酸![]() 络合萃取法可从工业废水中提取金属离子:
络合萃取法可从工业废水中提取金属离子:![]() 先将金属离子络合成电中性的物质
先将金属离子络合成电中性的物质![]() 如
如![]() 等
等![]() ,再用
,再用![]() 萃取此络合物。图2是用上述方法处理含有
萃取此络合物。图2是用上述方法处理含有![]() 、
、![]() 、
、![]() 的废水时的酸度曲线(E%表示金属离子以络合物形式被萃取分离的百分率)。
的废水时的酸度曲线(E%表示金属离子以络合物形式被萃取分离的百分率)。
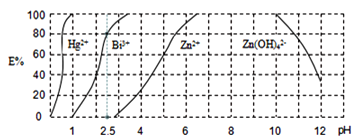
①当![]() :
:![]() :4时,废水的
:4时,废水的![]() ______。
______。
②向萃取后的![]() 中加入足量的NaOH溶液可将铋元素以氢氧化物的形式沉淀下来,相应的离子方程式为___。
中加入足量的NaOH溶液可将铋元素以氢氧化物的形式沉淀下来,相应的离子方程式为___。
(5)取焙烧得到的![]() 样品
样品![]() ,加入稀硫酸和
,加入稀硫酸和![]() 溶液使其完全溶解。已知
溶液使其完全溶解。已知![]() 被还原为
被还原为![]() ,
,![]() 被氧化成成
被氧化成成![]() ,试写出该反应的离子方程式:____。然后用新配制的
,试写出该反应的离子方程式:____。然后用新配制的![]() 溶液对生成的
溶液对生成的![]() 进行滴定,滴定完成后稍耗
进行滴定,滴定完成后稍耗![]() 溶液。则该样品中
溶液。则该样品中![]() 纯度为____。
纯度为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮的氧化物是造成大气污染的主要物质。研究氮氧化物的反应机理对于消除环境污染有重要意义。
(1)NO在空气中存在如下反应:2NO(g)+O2(g)![]() 2NO2(g) △H,上述反应分两步完成,其反应历程如下图所示:
2NO2(g) △H,上述反应分两步完成,其反应历程如下图所示:

回答下列问题:
①写出反应I的热化学方程式_________。
②反应I和反应Ⅱ中,一个是快反应,会快速建立平衡状态,而另一个是慢反应。决定2NO(g)+O2(g)![]() 2NO2(g)反应速率的是_______(填“反应I”或“反应Ⅱ”);对该反应体系升高温度,发现总反应速率反而变慢,其原因可能是__________(反应未使用催化剂)。
2NO2(g)反应速率的是_______(填“反应I”或“反应Ⅱ”);对该反应体系升高温度,发现总反应速率反而变慢,其原因可能是__________(反应未使用催化剂)。
(2)用活性炭还原法处理氮氧化物的有关反应为:C(s)+2NO(g)![]() N2(g)+CO2(g)。向恒容密闭容器中加入一定量的活性炭和NO,T℃时,各物质起始浓度及10min和20min各物质平衡浓度如表所示:
N2(g)+CO2(g)。向恒容密闭容器中加入一定量的活性炭和NO,T℃时,各物质起始浓度及10min和20min各物质平衡浓度如表所示:

①T℃时,该反应的平衡常数为_____________________(保留两位有效数字)。
②在10min时,若只改变某一条件使平衡发生移动,20min时重新达到平衡,则改变的条件是__________________________________。
③在20min时,保持温度和容器体积不变再充入NO和N2,使二者的浓度均增加至原来的两倍,此时反应v正_______v逆(填“>”、“<”或“=”)。
(3)NO2存在如下平衡:2NO2(g)![]() N2O4(g) △H<0,在一定条件下NO2与N2O4的消耗速率与各自的分压(分压=总压×物质的量分数)有如下关系:v(NO2)=k1·p2(NO2),v(N2O4)=k2·p(N2O4),相应的速率与其分压关系如图所示。
N2O4(g) △H<0,在一定条件下NO2与N2O4的消耗速率与各自的分压(分压=总压×物质的量分数)有如下关系:v(NO2)=k1·p2(NO2),v(N2O4)=k2·p(N2O4),相应的速率与其分压关系如图所示。

一定温度下,k1、k2与平衡常数kp(压力平衡常数,用平衡分压代替平衡浓度计算)间的关系是k1=____________;在上图标出点中,指出能表示反应达到平衡状态的点是___,理由是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年诺贝尔化学奖花落锂离子电池,美英日三名科学家获奖,他们创造了一个可充电的世界。像高能LiFePO4电池,多应用于公共交通。电池中间是聚合物的隔膜,主要作用是在反应过程中只让Li+通过。结构如图所示。

原理如下:(1x)LiFePO4+xFePO4+LixCn![]() LiFePO4+nC。下列说法不正确的是( )
LiFePO4+nC。下列说法不正确的是( )
A.放电时,正极电极反应式:xFePO4+xLi++xe-=xLiFePO4
B.放电时,电子由负极经导线、用电器、导线到正极
C.充电时,阴极电极反应式:xLi++xe-+nC=LixCn
D.充电时,Li+向左移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物M属于功能高分子材料。实验室由化合物A和B制备M(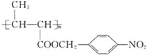 )的一种合成路线如下:
)的一种合成路线如下:

已知: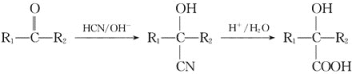 (R1、R2表示氢原子或烃基)。
(R1、R2表示氢原子或烃基)。
回答下列问题:
(1)A的结构简式为______;B中官能团的名称为_____;C的化学名称为_____。
(2)由B生成F和由D生成E的反应类型分别为____、____;由G生成H的反应试剂和反应条件分别为______。
(3)由E和I生成M的化学方程式为_________________________________。
(4)同时满足下列条件的E的同分异构体共有________种(不考虑立体异构,不包括本身)。
①硝基与苯环直接相连。 ②与钠反应放出H2。
(5)参照上述合成路线和信息,设计以丙酮为原料无机试剂任选,制备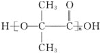 的合成路线:______________________。
的合成路线:______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】交联聚合物P的结构片段如图所示。下列说法不正确的是(图中![]() 表示链延长)
表示链延长)

A. 聚合物P中有酯基,能水解
B. 聚合物P的合成反应为缩聚反应
C. 聚合物P的原料之一丙三醇可由油脂水解获得
D. 邻苯二甲酸和乙二醇在聚合过程中也可形成类似聚合物P的交联结构
查看答案和解析>>
科目:高中化学 来源: 题型:
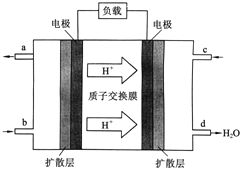
【题目】中国科学院长春应用化学研究所在甲醇燃料电池技术方面获得新突破,组装出了自呼吸电池及主动式电堆![]() 甲醇燃料电池的工作原理如图所示.
甲醇燃料电池的工作原理如图所示.
![]() 该电池工作时,b口通入的物质为______,c口通入的物质为______.
该电池工作时,b口通入的物质为______,c口通入的物质为______.
![]() 该电池负极的电极反应式为:______.
该电池负极的电极反应式为:______.
![]() 工作一段时间后,当
工作一段时间后,当![]() 甲醇完全反应生成
甲醇完全反应生成![]() 时,有______
时,有______![]() 个电子转移.
个电子转移.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】放热反应CO(g)+H2O(g)![]() CO2(g)+H2(g)在温度t1时达到平衡,c1(CO)=c1(H2O)=1.0 mol·L-1,其平衡常数为K1。其他条件不变,升高反应体系的温度至t2时,反应物的平衡浓度分别为c2(CO)和c2(H2O),平衡常数为K2,则
CO2(g)+H2(g)在温度t1时达到平衡,c1(CO)=c1(H2O)=1.0 mol·L-1,其平衡常数为K1。其他条件不变,升高反应体系的温度至t2时,反应物的平衡浓度分别为c2(CO)和c2(H2O),平衡常数为K2,则
A.若增大CO的浓度,K2 和K1都增大 B.K2 >K1
C.c2(CO)=c2(H2O) D. c1(CO)>c2(CO)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为测定某有机化合物A的结构,进行如下实验:
(1)将一定量的有机物A置于氧气流中充分燃烧,实验测得:生成5.4gH2O和8.8gCO2,消耗氧气6.72L(标准状况下),则该物质的实验式是__。
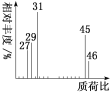
(2)用质谱仪测定该有机化合物的相对分子质量,得到如图所示的质谱图,则其相对分子质量为__,该物质的分子式是__。
(3)根据价键理论,预测A的可能结构并写出结构简式:__。
(4)核磁共振氢谱能对有机物分子中不同位置的氢原子给出不同的峰值(信号),根据峰值(信号)可以确定分子中氢原子的种类和数目。例如,甲基氯甲基醚(ClCH2OCH3,有2种氢原子)的核磁共振氢谱如图甲所示:
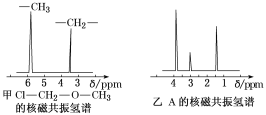
经测定,有机物A的核磁共振氢谱如图乙所示,则A的结构简式为__。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com