


科目:高中化学 来源: 题型:阅读理解
| T/K | 303 | 313 | 323 |
| NH3生成量/(10-6mol) | 4.8 | 5.9 | 6.0 |
 NH3H2O+H+
NH3H2O+H+ NH3H2O+H+
NH3H2O+H+查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
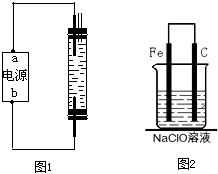 (2010?烟台一模)2008年5月12日我国四川汶川发生特大地震,为防止在大灾之后疫病流行,全国各地向灾区运送了大量的各种消毒液,如NaClO溶液.某校探究性学习小组对消毒液次氯酸钠(NaClO)的制备与性质等进行了探究.
(2010?烟台一模)2008年5月12日我国四川汶川发生特大地震,为防止在大灾之后疫病流行,全国各地向灾区运送了大量的各种消毒液,如NaClO溶液.某校探究性学习小组对消毒液次氯酸钠(NaClO)的制备与性质等进行了探究.查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
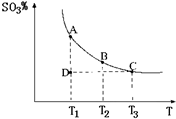 (2011?松江区模拟)运用化学反应原理研究氮、硫、氯、碘等单质及其化合物的反应有重要意义.
(2011?松江区模拟)运用化学反应原理研究氮、硫、氯、碘等单质及其化合物的反应有重要意义. 2SO3(g),混合体系中SO3的百分含量和温度的关系如图所示(曲线上任何一点都表示平衡状态).根据图示回答下列问题:
2SO3(g),混合体系中SO3的百分含量和温度的关系如图所示(曲线上任何一点都表示平衡状态).根据图示回答下列问题: 2SO3(g)是
2SO3(g)是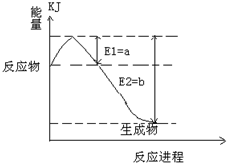
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解

| 10-7b |
| a-b |
| 10-7b |
| a-b |
查看答案和解析>>
科目:高中化学 来源: 题型:
 研究化学反应原理对于生产、生活及环境保护具有重要意义.
研究化学反应原理对于生产、生活及环境保护具有重要意义.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com