
科目:高中化学 来源: 题型:
(16分) 硫—碘循环分解水制氢主要涉及下列反应:
I SO2+2H2O+I2==H2SO4+2HI
II 2HI H2+I2
III 2H2SO4==2SO2+O2+2H2O
(1)分析上述反应,下列判断正确的是 。
a.反应III易在常温下进行
b.反应I中SO2氧化性比HI强
c.循环过程中需补充H2O
d.循环过程中产生1molO2的同时产生1 molH2
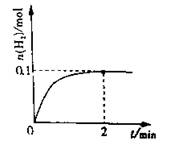
(2)一定温度下,向1L密闭容器中加入1molHI(g),发生反应II,H2物质的量随时间的变化如图所示。0~2min内的平均反应速率v(HI)= 。该温度下,H2(g)+I2(g)2HI(g)的平衡常数K= 。相同温度下,若开始加入HI(g)的物质的量是原来的2倍,则 是原来的2倍。
a.平衡常数 b.HI的平衡浓度
c.达到平衡的时间 d.平衡时H2的体积分数
(3)实验室用Zn和稀硫酸制取H2,反应时溶液中水的电离平衡 移动(填“向左”“向右”或“不”);若加入少量下列试剂中的 ,产生H2的速率将增大。
a.NaNO3 b.CuSO4 c.Na2SO4 d.NaHSO3
(4)以H2为燃料可制作氢氧燃料电池。
已知 2H2(g)+O2(g)====2H2O(l) △H=-572kJ·mol-1
某氢氧燃料电池释放22.8kJ电能时,生成1mol液态水,该电池的能量转化率为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列热化学方程式中,正确的是( )
A.甲烷的燃烧热ΔH=-890.3 kJ·mol-1,则甲烷燃烧的热化学方程式可表示为:
CH4(g)+2O2(g)=CO2(g)+2H2O(g) ΔH=-890.3 kJ·mol-1
B.500 ℃、30 MPa下,将0.5 mol N2和1.5 molH2置于密闭容器中充分反应生成NH3(g),放热19.3 kJ,其热化学方程式为: N2(g)+3H2(g)2 NH3(g) ΔH = -38.6kJ·mol-1
C.HCl和NaOH反应的中和热ΔH= -57.3kJ·mol-1,则H2SO4和Ca(OH)2反应的中和热ΔH=2×(-57.3)kJ·mol-1
D.在101 kPa时,2 g H2完全燃烧生成液态水,放出285.8kJ热量,氢气燃烧的热化学方程式表示为2 H2(g)+O2(g)=2 H2O(l) ΔH= -571.6 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源:2011-2012学年武汉市高三新起点调研测试化学试卷 题型:填空题
(12 分)能源问题是人类社会面临的重大课题。甲醇是未来重要的绿色能源之一。
(l)已知:在 25 ℃、101 kPa 下,1g 甲醇燃烧生成 CO2和液态水时放热 22.70kJ 。请写出甲醇燃烧的热化学方程式 。
(2)由CO2和H2合成甲醇的化学方程式为:CO2(g)+ 3H2
(g) CH3OH(g)+H2O (g ).在其它条件不变的情况下,实验测得温度对反应的影响如下图所示(注:T1、T2均大于300 ℃)
CH3OH(g)+H2O (g ).在其它条件不变的情况下,实验测得温度对反应的影响如下图所示(注:T1、T2均大于300 ℃)
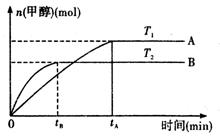
①合成甲醇反应的△H 0。(填“>”、“<”或“=” )。
②平衡常数的表达式为: .温度为T2时的平衡常数 温度为T1时的平衡常数(填“>”、“<”或“=”)
③在T1温度下,将1mol CO2和 1 molH2充入一密闭恒容容器中,充分反应达到平衡后,若CO2转化率为α,则容器内的压强与起始压强的比值为 。
(3)利用甲醇燃料电池设计如下图所示的装置。
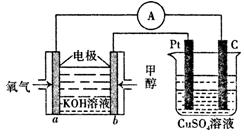
该装置中 Pt 极为 极;写出 b极的电极反应式 .
查看答案和解析>>
科目:高中化学 来源:2011-2012学年山东省潍坊市高三上学期期末考试化学试卷 题型:填空题
(l4分)向2L固定容积的密闭容器中加入一定量的NH3,H2和N2三种气体。一定条件下发生反应2NH3  N2+3H2,各物质浓度随时间变化如图1所示。图2为t时刻后改变容器中条件,平衡体系中反应速率随时间变化的情况,且两个阶段各改变一种不同的条件。
N2+3H2,各物质浓度随时间变化如图1所示。图2为t时刻后改变容器中条件,平衡体系中反应速率随时间变化的情况,且两个阶段各改变一种不同的条件。
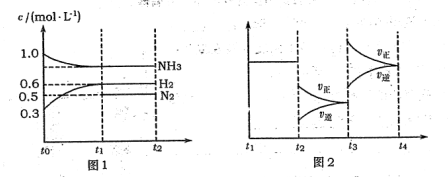
(1)能证明反应达到平衡状态的是 (填标号,下同)。
A.容器内压强不再发生变化 B. N2的体积分数不再发生变化
C. 容器内气体质量不再发生变化 D. 容器内气体密度不再发生变化
(2)若tl=15 s,则t0-t1阶段以H2浓度变化表示的反应速率为 。
(3)t3-t4阶段改变的条件为 。
(4)上述反应的平衡常数K= (保留两位小数);向容器中再通入1.4molNH3、0.8 molH2,平衡 移动(填“向右”、“向左”或“不移动”)。
(5)25OC时,将a mol·L-1的氨水与0.1 mol·L-1的盐酸等体积混合。
①当溶液中离子浓度关系满足c(NH4+)<c(Cl-)时,则反应的情况可能为
a.盐酸不足,氨水剩余 b. 氨水与盐酸恰好完全反应 c.盐酸过量
②当溶液中c(NH4+)=c(Cl-)时,用含a的代数式表示NH3·H2O的电离常数Kb= 。
查看答案和解析>>
科目:高中化学 来源:2010-2011学年广东省高三全真高考模拟(四)(理综)化学部分 题型:填空题
(16分) 硫—碘循环分解水制氢主要涉及下列反应:
I SO2+2H2O+I2==H2SO4+2HI
II 2HI  H2+I2
H2+I2
III 2H2SO4==2SO2+O2+2H2O
(1)分析上述反应,下列判断正确的是 。
a.反应III易在常温下进行
b.反应I中SO2氧化性比HI强
c.循环过程中需补充H2O
d.循环过程中产生1molO2的同时产生1 molH2
(2)一定温度下,向1L密闭容器中加入1molHI(g),发生反应II,H2物质的量随时间的变化如图所示。0~2min内的平均反应速率v(HI)=
。该温度下,H2(g)+I2(g) 2HI(g)的平衡常数K= 。相同温度下,若开始加入HI(g)的物质的量是原来的2倍,则
是原来的2倍。
2HI(g)的平衡常数K= 。相同温度下,若开始加入HI(g)的物质的量是原来的2倍,则
是原来的2倍。

a.平衡常数 b.HI的平衡浓度
c.达到平衡的时间 d.平衡时H2的体积分数
(3)实验室用Zn和稀硫酸制取H2,反应时溶液中水的电离平衡 移动(填“向左”“向右”或“不”);若加入少量下列试剂中的 ,产生H2的速率将增大。
a.NaNO3 b.CuSO4 c.Na2SO4 d.NaHSO3
(4)以H2为燃料可制作氢氧燃料电池。
已知 2H2(g)+O2(g)====2H2O(l) △H=-572kJ·mol-1
某氢氧燃料电池释放22.8kJ电能时,生成1mol液态水,该电池的能量转化率为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com