
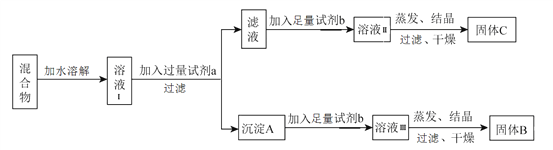
【题目】某同学设计如下实验方案,用以分离 KCl和BaCl2两种混合物,供选试剂:Na2SO4溶液、K2CO3溶液、K2SO4溶液、盐酸。
下列说法中,正确的是
A. 试剂 a是K2SO4 溶液
B. 试剂 b是盐酸
C. 固体 C是BaCl2
D. 不加试剂 b,将滤液直接蒸发、结晶,过滤后干燥也能得到纯净的固体C
【答案】B
【解析】分离KCl和BaCl2两种固体混合物,可先溶于水得到溶液Ⅰ,然后加入过量试剂a为K2CO3使BaCl2转化为沉淀A,过滤后沉淀加入足量试剂b为盐酸,盐酸可生成溶液ⅢBaCl2溶液,经蒸发、结晶、干燥后可得固体B为BaCl2,所得滤液为KCl和K2CO3的混合物,加入足量试剂b为盐酸,盐酸与碳酸钾反应生成氯化钾,蒸发结晶得到固体C为KCl。故A. 试剂 a是K2CO3 溶液,选项A错误;B. 试剂 b是盐酸,选项B正确;C. 固体 C是KCl,选项C错误;D. 不加试剂 b,滤液中含有KCl和K2CO3,将滤液直接蒸发、结晶,过滤后干燥得到固体C为KCl和K2CO3的混合物,选项D错误。 答案选B。


科目:高中化学 来源: 题型:
【题目】在玻璃中加入溴化银(AgBr)和氧化铜可制得变色镜片,其中所含物质及变色原理如图所示,下列说法不正确的是( )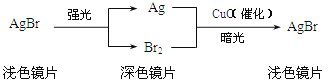
A.溴化银应避光保存
B.变色镜片可反复变色
C.变色镜片颜色变深的过程发生了化合反应
D.变色镜片中的氧化铜在变色过程中质量不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镁、铝的混合物共0.2mol,溶于200mL4mol·L-1的盐酸溶液中,然后再滴加2 mol·L-1的NaOH 溶液。若在滴加NaOH溶液的过程中,沉淀质量m 随加入NaOH溶液的体积V变化情况如图所示。请回答下列问题:
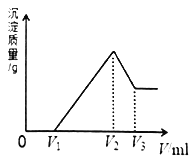
(1)当V1=160mL时,则金属粉末中m(Al)=_____________mol。
(2)V2~V3段发生反应的离子方程式为____________________________。
(3)若在滴加NaOH溶液的过程中,欲使Mg2+、Al3+刚好沉淀完全,则加入NaOH 溶液的体积V(NaOH)=____________mL。
(4)若镁、铝的混合物仍为0.2mol,其中镁粉的物质的量分数为a,改用200mL4 mol·L-1的硫酸溶解此混合物后,再加入840mL 2 mol·L-1的NaOH溶液,所得沉淀中无Al(OH)3,则a的取值范围为_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由黄铜矿(主要成分是CuFeS2)炼制精铜的工艺流 程示意图如下:
[铜矿石] ![]() [铜精矿石]
[铜精矿石] ![]() [冰铜]
[冰铜] ![]() [粗铜]
[粗铜] ![]() [电解铜]
[电解铜]
(1)在反射炉中,把铜精矿砂和石英砂混合加热到1000℃左右,黄铜矿与空气反应生成Cu和Fe的低价硫化物,且部分Fe的硫化物转变为低价氧化物.
①该过程中两个主要反应的化学方程式分别是、;
②反射炉内生成炉渣的主要成分是 .
(2)冰铜(Cu2S和FeS互相熔合而成)含Cu量为20%~50%.转炉中,将冰铜加熔剂(石英砂)在1200℃左右吹入空气进行吹炼.冰铜中的Cu2S被氧化为Cu2O.生成的Cu2O与Cu2S反应,生成含Cu量约为98.5%的粗铜.该过程发生反应的化学方程式分别是、 .
(3)粗铜的电解精炼如图所示.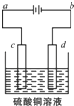
①在粗铜的电解过程中,粗铜板应是图中电极(填图中的字母);
②在电极d上发生的电极反应式为;
③若粗铜中还含有Au、Ag、Fe,它们在电解槽中的存在形式和位置为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质的保存方法正确的是
A.氢氧化钠溶液保存在玻璃塞的玻璃瓶中
B.漂白粉露置于空气中
C.浓硝酸、氯水保存在棕色细口玻璃瓶中
D.钠保存在盛有水的试剂瓶中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(酸碱中和滴定是利用中和反应,用已知浓度的酸(或碱)来测定未知浓度的碱(或酸)的实验方法,其中溶液的pH变化是判断滴定终点的依据.
实验 | 消耗0.1000molL﹣1的 | 待测氢氧化钠 |
1 | 29.02 | 25.00 |
2 | 28.01 | 25.00 |
3 | 27.99 | 25.00 |
(1)如图所示A的pH范围使用的指示剂是;
(2)用0.1000molL﹣1的盐酸溶液滴定未知浓度的氢氧化钠溶液,重复三次的实验数据如表所示.则待测氢氧化钠的物质的量浓度是molL﹣1 . 在上述滴定过程中,若滴定前滴定管下端尖嘴中有气泡,滴定后气泡消失,则测定结果将(填“偏高”、“偏低”或“不影响”).
(3)下列关于上述中和滴定过程中的操作正确的是(填序号)
A.用碱式滴定管量取未知浓度的烧碱溶液
B.滴定管和锥形瓶都必须用待盛放液润洗
C.滴定中始终注视锥形瓶中溶液颜色变化
D.锥形瓶中的待测液可用量筒量取.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】标出下列氧化还原反应的电子转移数目和方向,并写出氧化剂
(1)5MnSO4 + 2NaClO3 + 4H2O ![]() 5MnO2 + Na2SO4 + Cl2 ↑+ 4H2SO4 ___________,氧化剂是______
5MnO2 + Na2SO4 + Cl2 ↑+ 4H2SO4 ___________,氧化剂是______
(2)2FeCl3 + 10NaOH + 3NaClO ![]() 2Na2FeO4 + 9NaCl + 5H2O_____________,氧化剂是_____
2Na2FeO4 + 9NaCl + 5H2O_____________,氧化剂是_____
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D为原子序数依次增大的四种短周期元素,A2﹣和B+具有相同的电子构型,C、D为同周期元素,C核外电子总数是最外层电子数的3倍;D元素最外层有一个未成对电子. 回答下列问题:
(1)C原子的核外电子排布式为 .
(2)单质A有两种同素异形体,其中沸点高的是(填分子式),原因是;A、B、D三元素组成的化合物所属的晶体类型是 .
(3)C和D反应可生成组成比为1:3的化合物E,E的立体构型为 , 中心原子的杂化轨道类型为 .
(4)A和B能够形成化合物1:1的化合物,写出此化合物的电子式 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com