
【题目】镁、铝的混合物共0.2mol,溶于200mL4mol·L-1的盐酸溶液中,然后再滴加2 mol·L-1的NaOH 溶液。若在滴加NaOH溶液的过程中,沉淀质量m 随加入NaOH溶液的体积V变化情况如图所示。请回答下列问题:
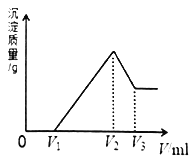
(1)当V1=160mL时,则金属粉末中m(Al)=_____________mol。
(2)V2~V3段发生反应的离子方程式为____________________________。
(3)若在滴加NaOH溶液的过程中,欲使Mg2+、Al3+刚好沉淀完全,则加入NaOH 溶液的体积V(NaOH)=____________mL。
(4)若镁、铝的混合物仍为0.2mol,其中镁粉的物质的量分数为a,改用200mL4 mol·L-1的硫酸溶解此混合物后,再加入840mL 2 mol·L-1的NaOH溶液,所得沉淀中无Al(OH)3,则a的取值范围为_______________________。
【答案】 0.08 Al(OH)3+OH-=AlO2-+2H2O 400 0.6≤a<1
【解析】(1)当V1=160mL时,此时溶液是MgCl2、AlCl3和NaCl的混合液,由Na+离子守恒可知,n(NaCl)=n(Na+)=n(NaOH)=0.16L×2mol/L=0.32mol。200mL 4molL-1的盐酸溶液中含有氯化氢的物质的量为:4mol/L×0.2L=0.8mol,设混合物中含有MgCl2为xmol、AlCl3为ymol,则:根据Mg原子、Al原子守恒有:x+y=0.2,根据Cl-离子守恒有:2x+3y=0.8-0.32=0.48,联立方程解得:x=0.12、y=0.08,所以金属粉末中:n(Mg)=0.12mol、n(Al)=y=0.08mol;(2)V2~V3段发生氢氧化钠溶解氢氧化铝的反应,反应的离子方程式为Al(OH)3+OH-=AlO2-+2H2O;(3)当溶液中Mg2+、Al3+恰好沉淀完全时,此时溶液是NaCl溶液,根据Cl-离子和Na+离子守恒有:n(Na+)=n(NaCl)=(HCl)=4mol/L×0.2L=0.8mol,所以需要加入氢氧化钠溶液体积为:V(NaOH)=0.8mol÷2mol/L=0.4L=400mL;(4)由于为金属混合物,则a<1,Al的物质的量为:0.2(1-a)mol,反应后的混合溶液中再加入840mL 2molL-1的NaOH溶液,所得沉淀中无Al(OH)3,则溶质为硫酸钠、偏铝酸钠,根据铝元素守恒可知:n(NaAlO2)=0.2(1-a)mol,根据钠离子守恒,应满足:n(NaOH)≥2n(Na2SO4)+n(NaAlO2),即0.84×2≥2×0.2×4+0.2(1-a),解得:a≥0.6,所以a的取值范围为:故0.6≤a<1。


 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案科目:高中化学 来源: 题型:
【题目】物质发生化学反应时,下列选项在反应前后肯定不发生变化的是( )
①原子总数 ②分子总数 ③电子总数 ④物质的种类 ⑤物质的总质量
A.①②③B.①③⑤C.②③⑤D.③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是一个简易测量物质反应是吸热还是放热的实验装置,利用此装置可以很方便地测得某反应是放热反应还是吸热反应.请根据装置回答下列问题: 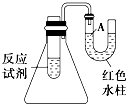
(1)将铝片加入小试管内,然后注入足量稀盐酸,有关反应的离子方程式是 , 试管中观察到的现象是 .
(2)U形导管中液面A(填“上升”或“下降”),原因是 , 说明此反应是(填“吸热”或“放热”)反应.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某中学学习小组模拟工业烟气脱硫(SO2)。
(1)甲组采用如下装置脱硫(部分装置略)。

① CaO脱硫后的产物是_________。
② b中品红很快褪色,说明脱硫效果不好。下列措施能提高脱硫效果的是_____。
ⅰ. 加快SO2气体流速
ⅱ. 将堆集在一起的CaO平铺在整个玻璃管
ⅲ. 加热a,脱硫效果可能会更好
③ 小组拟通过CaO的增重评价其脱硫能力。需要测量的数据是_______。
(2)乙组选用AgNO3溶液脱除SO2 。

现象:通入SO2,立即生成大量白色沉淀A。
对白色沉淀A的成分进行探究,提出假设:
假设1:发生了氧化还原反应,依据是AgNO3溶液中含有O2、![]() 等具有氧化性的粒子,沉淀A主要是Ag2SO4(微溶)。
等具有氧化性的粒子,沉淀A主要是Ag2SO4(微溶)。
假设2:发生了复分解反应,依据是SO2与水生成酸,能与AgNO3溶液发生复分解反应。
实验探究:
① 取沉淀A,加入蒸馏水,静置。取上层清液滴加Ba(NO3)2溶液,无明显变化。
② 取______,加入蒸馏水,静置。取上层清液滴加Ba(NO3)2溶液,产生沉淀。
实验证明“假设1”不成立。
③ 为进一步确认“假设2”,向A中加入浓HNO3,立即产生红棕色气体。加入浓硝酸的目的是________;经确认,反应后混合液存在SO![]() 。
。
实验证明“假设2”成立。
④ 产生沉淀A的化学方程式是_________。AgNO3溶液具有良好的脱硫能力,但因其价格高,未能大规模使用。
(3)丙组用NaClO脱除SO2,用1 L 0.1 mol/L 的NaClO溶液最多可以吸收标准状况下的SO2_______L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在以下各种情形下,下列电离方程式的书写正确的是( )
A.熔融状态下的NaHSO4电离:NaHSO4═Na++H++SO ![]()
B.Fe(OH)3的电离:Fe(OH)3?Fe3++3OH﹣
C.H2CO3的电离:H2CO3?2H++CO ![]()
D.水溶液中的NaHSO4电离:NaHSO4═Na++HSO ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组进行了有关Cu、硝酸、硫酸化学性质的实验,实验过程如图所示.下列有关说法正确的是( ) 
A.实验①中溶液呈蓝色,试管口有红棕色气体产生,说明稀硝酸被Cu还原为NO2
B.实验③中滴加稀硫酸,铜片继续溶解,说明稀硫酸的氧化性比稀硝酸强
C.实验③发生反应的化学方程式为:3Cu+Cu(NO3)2+4H2SO4═4CuSO4+2NO↑+4H2O
D.由上述实验可得出结论:Cu在常温下既可以和稀硝酸反应,也可以和稀硫酸反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,pH=11的氨水和NaOH溶液分别加水稀释100倍,溶液的pH随溶液体积变化的曲线如图所示.据图判断错误的是( ) 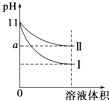
A.a的数值一定大于9
B.Ⅱ为氨水稀释时溶液的pH变化曲线
C.稀释后氨水中水的电离程度比NaOH溶液中水的电离程度大
D.完全中和相同体积的两溶液时,消耗相同浓度的稀硫酸的体积V(NaOH)<V(氨水)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学设计如下实验方案,用以分离 KCl和BaCl2两种混合物,供选试剂:Na2SO4溶液、K2CO3溶液、K2SO4溶液、盐酸。
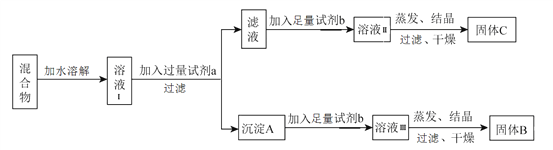
下列说法中,正确的是
A. 试剂 a是K2SO4 溶液
B. 试剂 b是盐酸
C. 固体 C是BaCl2
D. 不加试剂 b,将滤液直接蒸发、结晶,过滤后干燥也能得到纯净的固体C
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质的分类正确的是( )
单质 | 酸性氧化物 | 碱性氧化物 | 酸 | 碱 | 盐 | |
A | H2 | 干冰 | CuO | H2SO4 | 纯碱 | 熟石灰 |
B | 碘酒 | SO2 | Na2O | HCl | NH3·H2O | NaCl |
C | 液氯 | CO | Fe2O3 | CH3COOH | CH3CH2OH | 绿矾 |
D | HD | P2O5 | 生石灰 | HNO3 | KOH | CaCO3 |
A. A B. B C. C D. D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com