
【题目】某温度下,pH=11的氨水和NaOH溶液分别加水稀释100倍,溶液的pH随溶液体积变化的曲线如图所示.据图判断错误的是( ) 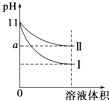
A.a的数值一定大于9
B.Ⅱ为氨水稀释时溶液的pH变化曲线
C.稀释后氨水中水的电离程度比NaOH溶液中水的电离程度大
D.完全中和相同体积的两溶液时,消耗相同浓度的稀硫酸的体积V(NaOH)<V(氨水)
 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案科目:高中化学 来源: 题型:
【题目】亚硝酸钙[Ca(NO2)2]是水泥混凝土外加剂的主要原料,某学习小组设计实验制备亚硝酸钙,实验装置如图所示(夹持装置略去).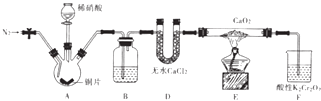
已知:2NO+CaO2═Ca(NO2)2;2NO2+CaO2═Ca(NO3)2
请回答下列问题:
(1)向三颈烧瓶中加入稀硝酸之前,应向装置中通入一段时间的N2 , 原因是 .
(2)仪器D的名称是;B中盛放的试剂是 .
(3)装置F中,酸性K2Cr2O7溶液可将剩余的NO氧化成NO3﹣ , 溶液由橙色变为绿色(Cr3+),发生反应的离子方程式是 .
(4)已知Ca(NO2)2溶液需保持弱碱性,因为其遇酸会发生反应,产生NO气体.设计实验证明E中有亚硝酸钙生成 .
(5)工业上可用石灰乳和硝酸工业的尾气(含NO、NO2)反应,既能净化尾气,又能获得应用广泛的Ca(NO2)2 , 反应原理为Ca(OH)2+NO+NO2=Ca(NO2)2+H2O.
①若n( NO):n(NO2)>1:1,则会导致:
②若n( NO):n( NO2)<1:1,则会导致 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为验证氯气的性质,某小组用如图所示的微型实验装置进行试验,a、b、c、d、e、是浸有相关溶液的滤纸.小组同学用KMnO4晶体与浓盐酸反应来制取少量的氯气,向KMnO4晶体滴加一滴浓盐酸后,立即用另一培养皿扣在上面.其化学方程式为:KMnO4+HCl(浓)→KCl+Cl2↑+MnCl2+H2O (未配平),请回答下列问题: 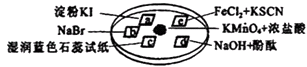
(1)上述反应中,元素的化合价升高;而元素被还原.
(2)配平上述反应: KMnO4+HCl(浓)═KCl+Cl2↑+MnCl2+H2O
(3)c处湿润蓝色石蕊试纸会先后 , 产生此现象的原因是: .
(4)e处滤纸的实验现象是: , 写出氯气与Fe2+反应的离子方程式是: .
(5)上述反应若在标准状况下产生56L的氯气,则转移电子为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镁、铝的混合物共0.2mol,溶于200mL4mol·L-1的盐酸溶液中,然后再滴加2 mol·L-1的NaOH 溶液。若在滴加NaOH溶液的过程中,沉淀质量m 随加入NaOH溶液的体积V变化情况如图所示。请回答下列问题:
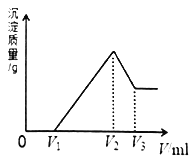
(1)当V1=160mL时,则金属粉末中m(Al)=_____________mol。
(2)V2~V3段发生反应的离子方程式为____________________________。
(3)若在滴加NaOH溶液的过程中,欲使Mg2+、Al3+刚好沉淀完全,则加入NaOH 溶液的体积V(NaOH)=____________mL。
(4)若镁、铝的混合物仍为0.2mol,其中镁粉的物质的量分数为a,改用200mL4 mol·L-1的硫酸溶解此混合物后,再加入840mL 2 mol·L-1的NaOH溶液,所得沉淀中无Al(OH)3,则a的取值范围为_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质中,满足表中图示物质在通常条件下一步转化关系的组合只有( )
序号 | X | Y | Z | W |
|
① | Cu | CuSO4 | Cu(OH)2 | CuO | |
② | Na | NaOH | Na2CO3 | NaCl | |
③ | Cl2 | Ca(ClO)2 | HClO | HCl | |
④ | Fe | FeCl3 | FeCl2 | Fe(OH)2 |
A.①②③
B.①③④
C.②③
D.①④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由黄铜矿(主要成分是CuFeS2)炼制精铜的工艺流 程示意图如下:
[铜矿石] ![]() [铜精矿石]
[铜精矿石] ![]() [冰铜]
[冰铜] ![]() [粗铜]
[粗铜] ![]() [电解铜]
[电解铜]
(1)在反射炉中,把铜精矿砂和石英砂混合加热到1000℃左右,黄铜矿与空气反应生成Cu和Fe的低价硫化物,且部分Fe的硫化物转变为低价氧化物.
①该过程中两个主要反应的化学方程式分别是、;
②反射炉内生成炉渣的主要成分是 .
(2)冰铜(Cu2S和FeS互相熔合而成)含Cu量为20%~50%.转炉中,将冰铜加熔剂(石英砂)在1200℃左右吹入空气进行吹炼.冰铜中的Cu2S被氧化为Cu2O.生成的Cu2O与Cu2S反应,生成含Cu量约为98.5%的粗铜.该过程发生反应的化学方程式分别是、 .
(3)粗铜的电解精炼如图所示.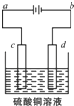
①在粗铜的电解过程中,粗铜板应是图中电极(填图中的字母);
②在电极d上发生的电极反应式为;
③若粗铜中还含有Au、Ag、Fe,它们在电解槽中的存在形式和位置为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质的保存方法正确的是
A.氢氧化钠溶液保存在玻璃塞的玻璃瓶中
B.漂白粉露置于空气中
C.浓硝酸、氯水保存在棕色细口玻璃瓶中
D.钠保存在盛有水的试剂瓶中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】标出下列氧化还原反应的电子转移数目和方向,并写出氧化剂
(1)5MnSO4 + 2NaClO3 + 4H2O ![]() 5MnO2 + Na2SO4 + Cl2 ↑+ 4H2SO4 ___________,氧化剂是______
5MnO2 + Na2SO4 + Cl2 ↑+ 4H2SO4 ___________,氧化剂是______
(2)2FeCl3 + 10NaOH + 3NaClO ![]() 2Na2FeO4 + 9NaCl + 5H2O_____________,氧化剂是_____
2Na2FeO4 + 9NaCl + 5H2O_____________,氧化剂是_____
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】C和Si元素在化学中占有极其重要的地位:
(1)写出Si的基态原子核外电子排布式 . 从电负性角度分析,C,Si和O元素的非金属活泼性由强至弱的顺序为 .
(2)CO2分子的空间构型为 , 中心原子的杂化方式为 , 和CO2 互为等电子体的氧化物是 .
(3)C,Si为同一主族的元素,CO2和SiO2化学式相似,但结构和性质有很大不同.CO2中C与O原子间原子间形成σ键和π键,SiO2中Si与O原子间不形成上述π键.从原子半径大小的角度分析,为何C、O原子间能形成,而Si、O原子间不能形成上述π键.
(4)金刚砂(SiC)的硬度为9.5,其晶胞结构如图所示;则金刚砂晶体类型为 , 在SiC中,每个C原子周围最近的C原子数目为 , 若晶胞的边长为a pm,则金刚砂的密度为 . 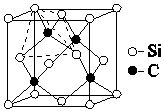
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com