
【题目】C和Si元素在化学中占有极其重要的地位:
(1)写出Si的基态原子核外电子排布式 . 从电负性角度分析,C,Si和O元素的非金属活泼性由强至弱的顺序为 .
(2)CO2分子的空间构型为 , 中心原子的杂化方式为 , 和CO2 互为等电子体的氧化物是 .
(3)C,Si为同一主族的元素,CO2和SiO2化学式相似,但结构和性质有很大不同.CO2中C与O原子间原子间形成σ键和π键,SiO2中Si与O原子间不形成上述π键.从原子半径大小的角度分析,为何C、O原子间能形成,而Si、O原子间不能形成上述π键.
(4)金刚砂(SiC)的硬度为9.5,其晶胞结构如图所示;则金刚砂晶体类型为 , 在SiC中,每个C原子周围最近的C原子数目为 , 若晶胞的边长为a pm,则金刚砂的密度为 . 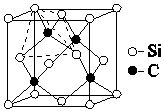
【答案】
(1)1s22s22p63s23p2;O>C>Si
(2)直线形;sp;N2O
(3)Si原子比C原子半径大,Si、O原子间距离较大,P﹣P轨道肩并肩重叠程度较小,不能形成上述稳定的π键
(4)原子晶体;12;![]()
【解析】解:(1)Si是14号元素,Si原子核外共14个电子,按照能量最低原则电子先填入能量最低的1s轨道,填满后再依次填入能量较高的轨道;其电子排布式为:1s22s22p63s23p2;从电负性的角度分析,O和C位于同一周期,非金属性O强于C;C和Si为与同一主族,C的非金属性强于Si,故由强到弱为O>C>Si, 所以答案是:1s22s22p63s23p2; O>C>Si;(2)CO2分子为直线形结构,可知碳原子采取sp杂化方式,原子数目相等、价电子总数也相等的微粒互为等电子体,和CO2 互为等电子体的氧化物是N2O,
所以答案是:直线形;sp;N2O;(3)CO2中C与O原子间形成σ键和π键,SiO2中Si与O原子间不形成上述π键,是因Si原子比C原子半径大,Si、O原子间距离较大,P﹣P轨道肩并肩重叠程度较小,不能形成上述稳定的π键,所以答案是:Si原子比C原子半径大,Si、O原子间距离较大,P﹣P轨道肩并肩重叠程度较小,不能形成上述稳定的π键;(4)金刚砂(SiC)的硬度为9.5,属于原子晶体;每个碳原子连接4个硅原子,每个硅原子又连接其它3个碳原子,所以每个碳原子周围最近的碳原子数目为3×4=12;该晶胞中C原子个数=8× ![]() +6×
+6× ![]() =4,Si原子个数为4,晶胞边长=a×10﹣10cm,体积V=(a×10﹣10cm)3 , ρ=
=4,Si原子个数为4,晶胞边长=a×10﹣10cm,体积V=(a×10﹣10cm)3 , ρ= ![]() =
= 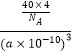 gcm3=
gcm3= ![]() gcm3;
gcm3;
所以答案是:原子晶体;12; ![]() .
.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】某温度下,pH=11的氨水和NaOH溶液分别加水稀释100倍,溶液的pH随溶液体积变化的曲线如图所示.据图判断错误的是( ) 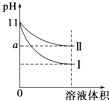
A.a的数值一定大于9
B.Ⅱ为氨水稀释时溶液的pH变化曲线
C.稀释后氨水中水的电离程度比NaOH溶液中水的电离程度大
D.完全中和相同体积的两溶液时,消耗相同浓度的稀硫酸的体积V(NaOH)<V(氨水)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列变化需要加入还原剂才能实现的转化是 ( )
A. KClO3→Cl2 B. Fe2+→Fe3+ C. H2S→SO2 D. HCO→CO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质的分类正确的是( )
单质 | 酸性氧化物 | 碱性氧化物 | 酸 | 碱 | 盐 | |
A | H2 | 干冰 | CuO | H2SO4 | 纯碱 | 熟石灰 |
B | 碘酒 | SO2 | Na2O | HCl | NH3·H2O | NaCl |
C | 液氯 | CO | Fe2O3 | CH3COOH | CH3CH2OH | 绿矾 |
D | HD | P2O5 | 生石灰 | HNO3 | KOH | CaCO3 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向20 mL 0.1 mol/L的K2CO3溶液中逐滴加入0.1 mol/L的稀盐酸40 mL,溶液中含碳元素的各种微粒(CO2因逸出未画出)的物质的量分数随溶液pH变化的情况如下图所示。下列说法正确的是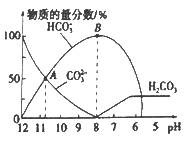
A.随着稀盐酸的加入,溶液中 ![]() 保持不变
保持不变
B.根据A点计算,Ka2 (H2CO3)的数量级为10-3
C.B 点所处的溶液中:c(K+)+c(H+)=2c(CO32-)+c(HCO3-)+c(OH-)
D.当pH约为8时,溶液中开始放出CO2气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】写出下列物质的化学式:
(1)重晶石___________________
(2)胆矾_____________________
(3)熟石膏____________________
(4)明矾_____________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中含有HCO3﹣、SO32﹣、Cl﹣和Na+ , 若向其中通入足量的Cl2 , 溶液中上述四种离子的浓度基本保持不变的是( )
A.HCO3﹣
B.SO32﹣
C.Cl﹣
D.Na+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】膳食纤维具有的突出保健功能,近年来受到人们的普遍关注,被世界卫生组织称为人体的“第七营养素”.木质素是一种非糖类膳食纤维,其单体之一是芥子醇,结构如图所示.下列有关芥子醇的说法正确的是( ) 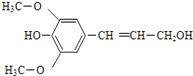
A.芥子醇的分子式是C11H12O4
B.芥子醇分子中所有碳原子可能在同一平面
C.1mol芥子醇能与足量溴水反应消耗3molBr2
D.1mol芥子醇与足量的氢气反应消耗氢气4mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,针对表中的①~⑧种元素,填写下列空白:
主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA |
2 | ① | ② | ③ | ④ | |||
3 | ⑤ | ⑥ | ⑦ | ⑧ |
(1)在最高价氧化物的水化物中,酸性最强的化合物的名称是______,碱性最强的化合物的化学式是_______。
(2)⑤⑦形成化合物的电子式___。②形成的最高价氧化物的结构式____。
(3)最高价氧化物是两性氧化物的元素其元素符号是____;写出它的氢氧化物与⑧的最高价氧化物的水化物反应的离子方程式________。
(4)⑥的单质与⑤的最高价氧化物的水化物反应的离子方程式是______。
(5)②和⑦可形成原子数1∶2的液态化合物甲,并能溶解⑦的单质,用电子式表示甲的形成过程:____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com