
【题目】某黑色粉末由两种物质组成,为鉴定其成分进行如下实验:
①取少量样品加入足量冷的稀硫酸,有气泡产生,固体部分溶解
②另取少量样品加入足量浓盐酸并加热,有气泡产生,固体全部溶解
该黑色粉末可能为( )
A.Fe、MnO2
B.C,FeS
C.Si、FeO
D.CuO,Ag2S
科目:高中化学 来源: 题型:
【题目】在下列无色溶液中,各组离子一定能够大量共存的是( )
A.Na+、H +、SO42-、OH- B.Na+、Cu 2+、NO3-、Cl-
C.H +、 Ca2+、Cl-、NO3- D.Ag+ 、 Na+、NO3-、Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验过程中,始终无明显现象的是( )
A.CO2通入饱和碳酸钠溶液中
B.在稀硫酸中加入铜粉,再加入KNO3固体
C.NO2通入FeSO4溶液中
D.SO2通入饱和CaCl2溶液中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知非金属单质硫(S)是淡黄色固体扮末,难溶于水。为了验证氯元素的非金属性比硫元素的非金属性强,某化学实验小组设计了如下实验。请回答下列问题:

(1)装置A的分液漏斗中盛装的试剂是_______,烧瓶中发生反应的离子方程式为_____________________。氧化剂与还原剂的物质的量之比为_________________。
(2)虚线框内的实验装置图中所加试剂为_______,说明装置的作用_________。
(3)装置B中盛放的试剂是_______(选填下列所给试剂的代码)。实验现象为________,离子方程式是___________,该反应属于四种基本反应类型中的_______反应。
A. Na2S溶液 B.Na2SO3溶液 C.Na2SO4溶液
(4)装置C中盛放烧碱溶液,目的是吸收反应后剩余的气体,防止污染空气。写出该反应的离子方程式_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水中含有氯化镁,是镁的重要来源之一。从海水中制取镁,可按如下步骤进行:
①把贝壳制成石灰乳 (主要成份是氢氧化钙) ②在引入的海水中加石灰乳,沉降、过滤、洗涤沉淀物 ③将沉淀物与盐酸反应,结晶、过滤、干燥产物 ④将得到的产物熔融后电解。关于从海水中提取镁,下列说法不正确的是
A. 此法的优点之一是原料来源丰富
B. 以上制取镁的过程中涉及的反应有分解反应、化合反应和置换反应
C. 第④步电解制镁是由于镁是很活泼的金属
D. 进行①②③步骤的目的是从海水中提取氯化镁
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关乙炔分子中的化学键描述不正确的是
A. 两个碳原子采用sp杂化方式 B. 两个碳原子采用sp2杂化方式
C. 每个碳原子都有两个未杂化的2p轨道形成π键 D. 两个碳原子形成两个π键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(14分)钛铁矿的主要成分为FeTiO3(可表示为FeO·TiO2),含有少量MgO、CaO、SiO2等杂质。利用钛铁矿制备锂离子电池电极材料(钛酸锂Li4Ti5O12和磷酸亚铁锂LiFePO4)的工业流程如下图所示:

已知:FeTiO3与盐酸反应的离子方程式为:FeTiO3+4H++4Cl—= Fe2++ TiOCl42—+2H2O
(1)化合物FeTiO3中铁元素的化合价是_______。
(2)滤渣A的成分是_______。
(3)滤液B中TiOCl42-和水反应转化生成TiO2的离子方程式是_______ 。
(4)反应②中固体TiO2转化成(NH4)2Ti5O15 溶液时,Ti元素的浸出率与反应温度的关系如图所示。反应温度过高时,Ti元素浸出率下降的原因_ 。

(5)反应③的化学方程式是 。
(6)由滤液D制备LiFePO4的过程中,所需17%双氧水与H2C2O4的质量比是_______。
(7)若采用钛酸锂(Li4Ti5O12)和磷酸亚铁锂(LiFePO4)作电极组成电池,其工作原理为:
Li4Ti5O12+ 3LiFePO4![]() Li7Ti5O12+ 3FePO4 该电池充电时阳极反应式是: 。
Li7Ti5O12+ 3FePO4 该电池充电时阳极反应式是: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,0.2mol/L的乙酸与等浓度的NaOH溶液等体积混合后,所得溶液中部分微粒组分及浓度如图所示,下列说法正确的是
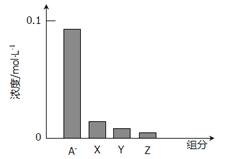
A. A可能表示Na+ B. A可能表示乙酸分子
C. 若图中A表示CH3COO-,可以证明乙酸是弱酸 D. 该混合溶液中:c(A)+c(Y)=c(X)+c(Z)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.中和等体积、等物质的量浓度的盐酸和醋酸所消耗的NaOH的物质的量相等
B.若NaHA溶液的pH<7,则H2A一定是强酸
C.将NaOH溶液加入到NH4Cl溶液至中性时,溶液中c(NH![]() )=c(Cl-)
)=c(Cl-)
D.常温下,将pH=11的Ba(OH)2溶液加水稀释10倍后,溶液的pH=12
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com