
【题目】(14分)钛铁矿的主要成分为FeTiO3(可表示为FeO·TiO2),含有少量MgO、CaO、SiO2等杂质。利用钛铁矿制备锂离子电池电极材料(钛酸锂Li4Ti5O12和磷酸亚铁锂LiFePO4)的工业流程如下图所示:

已知:FeTiO3与盐酸反应的离子方程式为:FeTiO3+4H++4Cl—= Fe2++ TiOCl42—+2H2O
(1)化合物FeTiO3中铁元素的化合价是_______。
(2)滤渣A的成分是_______。
(3)滤液B中TiOCl42-和水反应转化生成TiO2的离子方程式是_______ 。
(4)反应②中固体TiO2转化成(NH4)2Ti5O15 溶液时,Ti元素的浸出率与反应温度的关系如图所示。反应温度过高时,Ti元素浸出率下降的原因_ 。

(5)反应③的化学方程式是 。
(6)由滤液D制备LiFePO4的过程中,所需17%双氧水与H2C2O4的质量比是_______。
(7)若采用钛酸锂(Li4Ti5O12)和磷酸亚铁锂(LiFePO4)作电极组成电池,其工作原理为:
Li4Ti5O12+ 3LiFePO4![]() Li7Ti5O12+ 3FePO4 该电池充电时阳极反应式是: 。
Li7Ti5O12+ 3FePO4 该电池充电时阳极反应式是: 。
【答案】(1)+2; (2)SiO2; (3)TiOCl42—+ H2O![]() TiO2↓ + 2H++ 4Cl—
TiO2↓ + 2H++ 4Cl—
(4)温度过高时,反应物氨水(或双氧水)受热易分解
(5)(NH4)2Ti5O15+ 2 LiOH = Li2Ti5O15↓ + 2NH3·H2O(或2NH3+2H2O)
(6)20/9; (7)LiFePO4– e—=FePO4+ Li+
【解析】试题分析:(1)反应FeTiO3+4H++4Cl-=Fe2++TiOCl42-+2H2O中,不是非氧化还原反应,可以判断铁元素化合价为+2价,故答案为:+2;
(2)由于杂质中二氧化硅不溶于盐酸,所以滤渣A成分是二氧化硅,故答案为:SiO2;
(3)根据流程可知,TiOCl42-在溶液中加热与水反应生成二氧化钛沉淀,反应的离子方程式为:TiOCl42-+H2O=TiO2↓+2H++4Cl-,故答案为:TiOCl42-+H2O=TiO2↓+2H++4Cl-;
(4)由于二氧化钛与氨水、双氧水反应生成NH4)2Ti5O15时,温度过高,双氧水和氨水都容易分解,所以反应温度过高时,Ti元素浸出率下降,故答案为:温度过高时,反应物氨水(或双氧水)受热易分解;
(5)根据流程图示可知,反应3是(NH4)2Ti5O15与强氧化锂反应生成Li2Ti5O15沉淀和氨水,反应的化学方程式为:(NH4)2Ti5O15+2 LiOH=Li2Ti5O15↓+2NH3H2O(或2NH3+2H2O),故答案为:(NH4)2Ti5O15+2 LiOH=Li2Ti5O15↓+2NH3H2O(或2NH3+2H2O);
(6)根据电子守恒,氧化铁元素转移的电子就等于铁离子氧化草酸转移的电子数,
因此可得关系式:H2O2~H2C2O4,设双氧水质量为x,草酸质量为y,
34 90
x×17% y
34y=90×x×17%,x:y=20:9,
17%双氧水与H2C2O4的质量比为20:9,故答案为:20:9;
(7)充电时,阳极发生氧化反应,LiFePO4失去电子生成FePO4,电极反应为:LiFePO4-e-=FePO4+Li+,故答案为:LiFePO4-e-=FePO4+Li+。


 口算小状元口算速算天天练系列答案
口算小状元口算速算天天练系列答案科目:高中化学 来源: 题型:
【题目】下列解释事实的离子方程式正确的是 ( )
A.铁和稀硝酸反应制得浅绿色溶液:Fe + 4H + + NO 3-![]() Fe 3+ + NO↑+ 2H 2O
Fe 3+ + NO↑+ 2H 2O
B.向Ca(ClO) 2溶液中通入过量CO 2制取次氯酸:2ClO-+ H 2O + CO 2 ![]() 2HClO + CO 32-
2HClO + CO 32-
C.向酸性KMnO 4溶液中通入SO 2:2MnO 4-+5SO 2+4OH -=2Mn 2++5SO 42-+2H 2O
D.硫酸铜溶液中滴加氢氧化钡溶液:Ba2++2OH﹣+Cu2++SO42﹣=BaSO4↓+Cu(OH)2↓
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】普及化学知识有助于人们树立健康的观念。下列观念正确的是
A. 天然物质都是绿色无毒的物质 B. 只饮用纯净水有益人体健康
C. 微量元素只能通过保健品摄入 D. 禁止吸烟可减少室内空气污染
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某黑色粉末由两种物质组成,为鉴定其成分进行如下实验:
①取少量样品加入足量冷的稀硫酸,有气泡产生,固体部分溶解
②另取少量样品加入足量浓盐酸并加热,有气泡产生,固体全部溶解
该黑色粉末可能为( )
A.Fe、MnO2
B.C,FeS
C.Si、FeO
D.CuO,Ag2S
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某元素在化学反应中,由化合态变为游离态,则该元素( )
A.化合价降低为零 B.化合价一定降低
C.可能化合价降低,也可能化合价升高 D.化合价一定升高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在体积不变的绝热密闭容器中,一定量SO2与1molO2在催化剂作用下发生反应:![]() △H=-QkJ/mol(Q>0)。当气体的物质的量减少0.5mol时反应达到平衡。下列叙述正确的是
△H=-QkJ/mol(Q>0)。当气体的物质的量减少0.5mol时反应达到平衡。下列叙述正确的是
A. 再通入1molO2,平衡正向移动,平衡常数不变
B. 降低温度,正反应速率先减小后增大
C. 平衡时SO2气体的转化率为50%
D. 该条件下反应放出0.5QkJ的热量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫代硫酸钠又名“大苏打”,溶液具有弱碱性和较强的还原性,是棉织物漂白后的脱氯剂,定量分析中的还原剂。硫代硫酸钠(Na2S2O3)可由亚硫酸钠和硫粉通过化合反应制得,装置如图1所示。
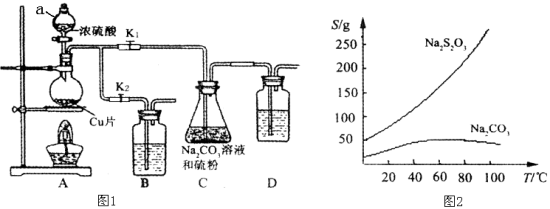
已知:Na2S2O3在酸性溶液中不能稳定存在,有关物质的溶解度曲线如图2所示,
(1)Na2S2O3·5H2O的制备:
步骤1:如图连接好装置后(未装药品),检查A、C装置气密性的操作是 。
步骤2:加入药品,打开K1、关闭K2,加热。装置B、D中的药品可选用下列物质中的 (填编号)。
A.NaOH溶液 B.浓H2SO4 C.酸性KMnO4溶液 D.饱和NaHCO3溶液
步骤3:C中混合液被气流搅动,反应一段时间后,硫粉的量逐渐减少。
步骤4:过滤C中的混合液,将滤液经过加热浓缩,趁热过滤,再将滤液 、过滤、洗涤、烘干,得到产品。
(2)Na2S2O3性质的检验:向足量的新制氯水中滴加少量Na2S2O3溶液,氯水颜色变浅,检查反应后溶液中含有硫酸根,写出该反应的化学方程式 。
(3)常用Na2S2O3溶液测定废水中Ba2+浓度,步骤如下:取废水25.00 mL,控制适当的酸度加入足量K2Cr2O7溶液,得BaCrO4沉淀;过滤、洗涤后,用适量稀盐酸溶解。此时CrO42-全部转化为Cr2O72-;再加过量KI溶液,充分反应后,加入淀粉溶液作指示剂,用0.010 mol·L-1的Na2S2O3溶液进行滴定,反应完全时,消耗Na2S2O3溶液18. 00 mL。部分反应的离子方程式为:Cr2O72- + 6 I- + 14H+ = 2 Cr3+ + 3 I2 + 7 H2O;I2 + 2 S2O32- = S4O62-+2I-。则该废水中Ba2+的物质的量浓度为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下实验或操作不能达到目的是( )
A.用分液漏斗除去苯中的少量苯酚
B.用氨水鉴别Mg2+和Ag+
C.用水鉴别苯、乙醇、四氯化碳
D.用激光笔检验淀粉溶液和葡萄糖溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向20.00 mL 0.100 0 mol·L-1 CH3COONa溶液中逐滴加入0.100 0 mol·L-1盐酸,混合溶液的pH与所加盐酸体积的关系如图所示。下列说法正确的是( )
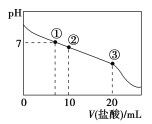
A.点①所示溶液中:c(Cl-)>c(CH3COOH)>c(OH-)=c(H+)
B.点②所示溶液中:c(Na+)>c(Cl-)>c(CH3COO-)>c(CH3COOH)
C.点③所示溶液中:c(Na+)>c(CH3COOH)>c(H+)>c(CH3COO-)
D.整个过程中:c(H+)+c(Na+)=c(CH3COOH)+c(CH3COO-)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com