
【题目】硫代硫酸钠又名“大苏打”,溶液具有弱碱性和较强的还原性,是棉织物漂白后的脱氯剂,定量分析中的还原剂。硫代硫酸钠(Na2S2O3)可由亚硫酸钠和硫粉通过化合反应制得,装置如图1所示。
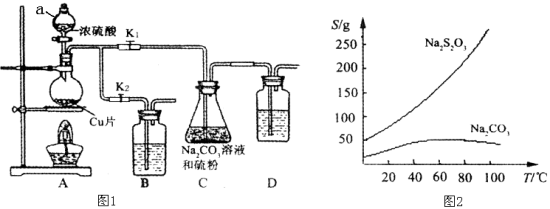
已知:Na2S2O3在酸性溶液中不能稳定存在,有关物质的溶解度曲线如图2所示,
(1)Na2S2O3·5H2O的制备:
步骤1:如图连接好装置后(未装药品),检查A、C装置气密性的操作是 。
步骤2:加入药品,打开K1、关闭K2,加热。装置B、D中的药品可选用下列物质中的 (填编号)。
A.NaOH溶液 B.浓H2SO4 C.酸性KMnO4溶液 D.饱和NaHCO3溶液
步骤3:C中混合液被气流搅动,反应一段时间后,硫粉的量逐渐减少。
步骤4:过滤C中的混合液,将滤液经过加热浓缩,趁热过滤,再将滤液 、过滤、洗涤、烘干,得到产品。
(2)Na2S2O3性质的检验:向足量的新制氯水中滴加少量Na2S2O3溶液,氯水颜色变浅,检查反应后溶液中含有硫酸根,写出该反应的化学方程式 。
(3)常用Na2S2O3溶液测定废水中Ba2+浓度,步骤如下:取废水25.00 mL,控制适当的酸度加入足量K2Cr2O7溶液,得BaCrO4沉淀;过滤、洗涤后,用适量稀盐酸溶解。此时CrO42-全部转化为Cr2O72-;再加过量KI溶液,充分反应后,加入淀粉溶液作指示剂,用0.010 mol·L-1的Na2S2O3溶液进行滴定,反应完全时,消耗Na2S2O3溶液18. 00 mL。部分反应的离子方程式为:Cr2O72- + 6 I- + 14H+ = 2 Cr3+ + 3 I2 + 7 H2O;I2 + 2 S2O32- = S4O62-+2I-。则该废水中Ba2+的物质的量浓度为 。
【答案】(1)关闭K2打开K1,在D中加水淹没导管末端,双手捂住烧瓶(2分)
ACD(2分) 冷却结晶(2分)
(2)Na2S2O3+4Cl2+5H2O=Na2SO4+H2SO4+8HCl(2分)
(3)0.0024mol·L-1(2分)
【解析】
试题分析:(1)根据装置图的特点,检查A、C装置气密性的操作是关闭K2打开K1,在D中加水淹没导管末端,用热毛巾或双手捂住烧瓶,若导气管末端有气泡冒出,松开热毛巾,在导气管中形成一段水柱,说明气密性良好;装置B、D的作用吸收SO2 ,防止污染空气,所以药品选用与SO2 反应的物质,下列物质中的NaOH、饱和NaHCO3溶液、酸性KMnO4溶液与SO2 反应,而浓硫酸不反应,选ADC;由于Na2S2O3在酸性溶液中不能稳定存在,容易分解,所以把pH控制在7~10之间;根据硫代硫酸钠的溶解度曲线图可知,硫代硫酸钠的溶解度随温度的升高而增大,所以获得产品的操作是将滤液经过加热浓缩,趁热过滤,再将滤液冷却结晶、过滤、洗涤、烘干,得到产品;(2)向足量的新制氯水中滴加少量Na2S2O3溶液,氯水颜色变浅,检查反应后溶液中含有硫酸根,说明S2O32-与Cl2反应生成SO42-,硫元素由+2价升高到+6价,则Cl2需得电子生成Cl-,该反应的化学方程式为Na2S2O3 + 4 Cl2 + 5 H2O = Na2SO4 + H2SO4 + 8 HCl;(3)根据题给信息可得如下关系式:Ba2+ ~ BaCrO4 ~ 0.5 Cr2O72- ~ 1.5 I2 ~ 3 Na2S2O3,则n(Ba2+)=1/3×0.010×18×1000-3 mol= 0.00006 mol,c(Ba2+) = 0.0006/0.025 mol·L-1=0.0024 mol·L-1。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】某温度下,相同pH的盐酸和醋酸溶液分别加水稀释,平衡pH随溶液体积变化的曲线如图所示。据图判断正确的是
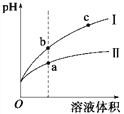
A. Ⅱ为盐酸稀释时的pH变化曲线
B. 溶液的导电性: a > b > c
C. a点KW的数值比c点KW的数值大
D. b点酸的总浓度大于a点酸的总浓度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水中含有氯化镁,是镁的重要来源之一。从海水中制取镁,可按如下步骤进行:
①把贝壳制成石灰乳 (主要成份是氢氧化钙) ②在引入的海水中加石灰乳,沉降、过滤、洗涤沉淀物 ③将沉淀物与盐酸反应,结晶、过滤、干燥产物 ④将得到的产物熔融后电解。关于从海水中提取镁,下列说法不正确的是
A. 此法的优点之一是原料来源丰富
B. 以上制取镁的过程中涉及的反应有分解反应、化合反应和置换反应
C. 第④步电解制镁是由于镁是很活泼的金属
D. 进行①②③步骤的目的是从海水中提取氯化镁
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(14分)钛铁矿的主要成分为FeTiO3(可表示为FeO·TiO2),含有少量MgO、CaO、SiO2等杂质。利用钛铁矿制备锂离子电池电极材料(钛酸锂Li4Ti5O12和磷酸亚铁锂LiFePO4)的工业流程如下图所示:

已知:FeTiO3与盐酸反应的离子方程式为:FeTiO3+4H++4Cl—= Fe2++ TiOCl42—+2H2O
(1)化合物FeTiO3中铁元素的化合价是_______。
(2)滤渣A的成分是_______。
(3)滤液B中TiOCl42-和水反应转化生成TiO2的离子方程式是_______ 。
(4)反应②中固体TiO2转化成(NH4)2Ti5O15 溶液时,Ti元素的浸出率与反应温度的关系如图所示。反应温度过高时,Ti元素浸出率下降的原因_ 。

(5)反应③的化学方程式是 。
(6)由滤液D制备LiFePO4的过程中,所需17%双氧水与H2C2O4的质量比是_______。
(7)若采用钛酸锂(Li4Ti5O12)和磷酸亚铁锂(LiFePO4)作电极组成电池,其工作原理为:
Li4Ti5O12+ 3LiFePO4![]() Li7Ti5O12+ 3FePO4 该电池充电时阳极反应式是: 。
Li7Ti5O12+ 3FePO4 该电池充电时阳极反应式是: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,0.2mol/L的乙酸与等浓度的NaOH溶液等体积混合后,所得溶液中部分微粒组分及浓度如图所示,下列说法正确的是
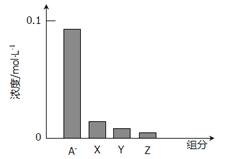
A. A可能表示Na+ B. A可能表示乙酸分子
C. 若图中A表示CH3COO-,可以证明乙酸是弱酸 D. 该混合溶液中:c(A)+c(Y)=c(X)+c(Z)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应:![]() 在固定容积的密闭容器中反应,达到平衡状态的标志是( )
在固定容积的密闭容器中反应,达到平衡状态的标志是( )
(1)单位时间内生成![]() 的同时生成
的同时生成![]()
(2)单位时间内生成![]() 的同时生成
的同时生成![]()
(3)用![]() 的物质的量浓度变化表示的反应速率的比为2:2:1的状态
的物质的量浓度变化表示的反应速率的比为2:2:1的状态
(4)混合气体的颜色不再改变的状态
A.(1)(4) B.(2)(3) C.(1)(3)(4) D.(1)(2)(3)(4)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】做氯化氢喷泉实验后,烧瓶内的液体只占烧瓶容积的三分之一,其原因可能是( )
A.HCl气体没有完全溶解
B.装置漏气,进入空气
C.集气时有空气混入
D.从胶头滴管挤入烧瓶的水太少
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质用途的说法中,正确的是( ) ①臭氧可用于漂白和消毒
②碳酸氢钠可用于治疗胃酸过多
③二氧化硅可用于制作光导纤维
④硅酸钠具有阻燃防火性能.
A.只有①②
B.只有②③
C.只有①②③
D.全部正确
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com