
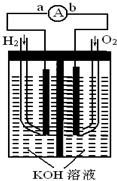
 燃料电池是一种能量转换效率高、对环境友好的化学电源,图为一种氢氧燃料电池的结构装置.
燃料电池是一种能量转换效率高、对环境友好的化学电源,图为一种氢氧燃料电池的结构装置.分析 (1)电极b通入氧气,为该燃料电池的正极,电极方程式为O2+2H2O+4e-=4OH-;
(2)原电池中阴离子向负极移动;
(3)电子流动由负极流向正极;
(4)总的反应式为:O2+2H2=2H2O,生成水溶液浓度变稀;
(5)产生标准状况下H2 为6.72L,所以物质的量为$\frac{6.72L}{22.4L/mol}$=0.3mol,生成1mol的氢气转移2mol的电子.
解答 解:(1)电极b通入氧气,为该燃料电池的正极,电极方程式为O2+2H2O+4e-=4OH-,故答案为:正;O2+2H2O+4e-=4OH-;
(2)原电池中阴离子向负极移动,溶液中的OH-移向a,故答案为:a;
(3)电子流动由负极流向正极,所以由a流向b,故答案为:a流向b;
(4)总的反应式为:O2+2H2=2H2O,生成水溶液浓度变稀,所以溶液的PH减小,故答案为:减少;
(5)产生标准状况下H2 为6.72L,所以物质的量为$\frac{6.72L}{22.4L/mol}$=0.3mol,生成1mol的氢气转移2mol的电子,所以转移电子的物质的量为:0.3mol×2=0.6mol,
故答案为:0.6.
点评 本题考查化学电源新型电池,侧重考查原电池原理,明确电解质溶液酸碱性是解本题关键,难点是电极反应式的书写,题目难度不大.


 名师金手指领衔课时系列答案
名师金手指领衔课时系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 0.1mol羟基中含有1 mol电子 | |
| B. | 乙烷和丙烯任意比混合的气体1mol,完成燃烧均生成3molH2O | |
| C. | CH2Cl2具有两种同分异构体 | |
| D. | 图中有机物(1-甲基环己烷)的一氯代物有4种 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题

| A. | B烧杯中加一定量的KCl固体可使溶液恢复原状 | |
| B. | c电极周围溶液变红 | |
| C. | A烧杯内Cu2+浓度降低 | |
| D. | d电极上可以析出使湿润的淀粉KI试纸变蓝的气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 降低温度 | B. | 加入适量的水 | ||
| C. | 加入少量CuSO4溶液 | D. | 加入浓度较大的盐酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 5项 | B. | 4项 | C. | 3项 | D. | 2项 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com