
| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
分析 (1)反应中C元素的化合价由0升高为+4价,Mn元素的化合价由+7价降低为+2价,结合化合价升降总数相等以及质量守恒定律配平;
(2)12g碳的物质的量为1mol,与水蒸气完全反应生成CO、H2,吸收131.6kJ热量,据此结合热化学方程式书写原则进行书写;
(3)①可逆反应达到平衡状态时,正逆反应速率相等(同种物质)或正逆反应速率之比等于系数之比(不同物质),平衡时各种物质的物质的量、浓度等不再发生变化,由此衍生的一些物理量不变,以此分析;
②计算CO的浓度变化量,由方程式可知△c(H2)=2△c(CO),根据v=$\frac{△c}{△t}$计算v(H2);
(4)燃料电池中,通入CO的一极为原电池的负极,发生氧化反应,电极反应式为2CO-4e-+2CO32-=4CO2;
(5)根据某温度下该反应的平衡常数K=4.0×10-2,写出表达式,找出与BaSO4、BaCO3的关系,进行计算即可.
解答 解:(1)反应中C元素的化合价由0升高为+4价,Mn元素的化合价由+7价降低为+2价,该反应中转移20e-,由电子守恒和质量守恒定律可知得化学反应为5C+4KMnO4+6HSO4=5CO2↑+4MnSO4+2K2SO4+6H2O,
故答案为:5;4;6;5;4;2;6;
(2)12g碳的物质的量为1mol,与水蒸气反应生成CO、H2,吸收131.6kJ热量,该反应的热化学方程式C(s)+H2O(g)=CO(g)+H2(g)△H=+131.6 kJ•mol-1,
故答案为:C(s)+H2O(g)=CO(g)+H2(g)△H=+131.6 kJ•mol-1;
(3)①A.无论反应是否达到平衡状态,生成CH3OH的速率与消耗CO的速率始终相等,所以不能作为判断平衡状态的依据,故错误;
B.反应前后,混合气体的物质的量改变,气体的质量不变,反应达到平衡状态时,混合气体的相对平均分子质量不变,所以能作为判断平衡状态的依据,故正确;C.混合物的质量始终不变,容器的体积不变,所以混合气体的密度始终不变,所以不能作为判断平衡状态的依据,故错误;
D.反应达到平衡状态时,CH3OH、CO、H2的浓度都不再发生变化,所以能作为判断平衡状态的依据,故正确;
故选BD;
②△c(H2)=2△c(CO)=2×($\frac{2mol}{2L}$-0.2mol/L)=1.6mol/L,由v(H2)=$\frac{△c}{△t}$=$\frac{1.6mol/L}{10min}$=0.16 mol/(L•min),故答案为:0.16 mol/(L•min);
(4)燃料电池中,通入CO的一极为原电池的负极,发生氧化反应,电极反应式为2CO-4e-+2CO32-=4CO2,通入氧气和CO2的混合气体一极为原电池的正极,发生还原反应,电极反应式为O2+4e-+2CO2=2CO32-;原电池电极反应,正极上的电极反应式为O2+4e-+2CO2=2CO32-;负极上的电极反应式为2CO-4e-+2CO32-=4CO2;
故答案为:2CO-4e-+2CO32-=4CO2;
(5)反应:BaSO4(s)+CO32-(aq)?BaCO3(s)+SO42-(aq),K=4.0×10-2=$\frac{c(S{O}_{4}^{2-})}{c(C{O}_{3}^{2-})}$=$\frac{c(S{O}_{4}^{2-})}{c(C{O}_{3}^{2-})}$×$\frac{c(B{a}^{2+})}{c(B{a}^{2+})}$=$\frac{Ksp(BaS{O}_{4})}{Ksp(BaC{O}_{3})}$=$\frac{1.0×1{0}^{-10}}{Ksp(BaC{O}_{3})}$,
Ksp(BaCO3)=2.5×10-9,
故答案为:2.5×10-9.
点评 本题考查热化学方程式的书写、氧化还原方程式的书写,注重高频考点的考查,综合性强,题目难度较大,注意书写热化学方程式时要注明物质的状态.


科目:高中化学 来源: 题型:选择题
| A. | 相同质量的CO2(g)和干冰相比较,干冰的能量一定高于CO2(g) | |
| B. | 化学反应过程中能量的变化只可能有吸热和放热两种表现形式 | |
| C. | 同温同压下,反应H2(g)+Cl2(g)═2HCl(g)在光照和点燃条件的△H相同 | |
| D. | 放热的反应在常温下一定能自发进行 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
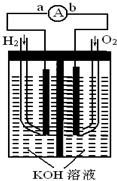 燃料电池是一种能量转换效率高、对环境友好的化学电源,图为一种氢氧燃料电池的结构装置.
燃料电池是一种能量转换效率高、对环境友好的化学电源,图为一种氢氧燃料电池的结构装置.查看答案和解析>>
科目:高中化学 来源: 题型:推断题
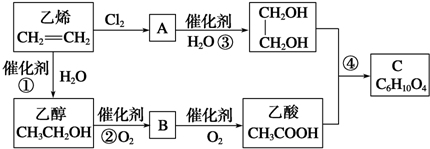
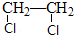
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 位于周期表的第七周期第ⅣA族 | B. | 原子的最外层有4个电子 | ||
| C. | 肯定是非金属元素 | D. | 常见的化合价有+2和+4价 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | O、S、Na的原子半径依次增大 | B. | LiOH、NaOH、KOH的碱性依次减弱 | ||
| C. | NH3、H2O(气态)、HF的稳定性依次减弱 | D. | Cl2、Br2、I2的氧化性依次增强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1个甘氨酸分子中存在9对共用电子对(甘氨酸的结构简式为NH2-CH2-COOH) | |
| B. | PCl3和BCl3分子中所有原子的最外层都达到8电子稳定结构 | |
| C. | H2S和CS2分子都是含极性键的极性分子 | |
| D. | 正四面体分子中键角可能是109°28′或60° |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com