
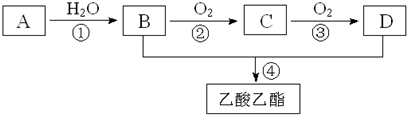
���� A�IJ���ͨ����������һ�����ҵ�ʯ�ͻ���ˮƽ����AΪCH2=CH2����ˮ�����ӳɷ�Ӧ�õ�BΪCH3CH2OH��
�Ҵ������ᷢ��������Ӧ������������������DΪCH3COOH���Ҵ���������������ȩ����ȩ�������������ᣬ����CΪCH3CHO���Դ˽����⣮
��� �⣺A�IJ���ͨ����������һ�����ҵ�ʯ�ͻ���ˮƽ����AΪCH2=CH2����ˮ�����ӳɷ�Ӧ�õ�BΪCH3CH2OH��
�Ҵ������ᷢ��������Ӧ������������������DΪCH3COOH���Ҵ���������������ȩ����ȩ�������������ᣬ����CΪCH3CHO��
��1��A�Ľṹ��ʽΪCH2=CH2���ʴ�Ϊ��CH2=CH2��
��2��BΪ�Ҵ���������Ϊ�ǻ���DΪ���ᣬ���еĹ�����Ϊ�Ȼ����ʴ�Ϊ���ǻ����Ȼ���
��3��AΪCH2=CH2����ˮ�����ӳɷ�Ӧ����CH3CH2OH����Ϊ�Ҵ���������Ӧ����Ϊ������Ҵ���������Ӧ��
�ʴ�Ϊ���ӳɣ�������������ȡ������
��4����Ϊ��ϩ��ˮ�ļӳɷ�Ӧ����Ӧ����ʽΪCH2=CH2+H2O$\stackrel{һ������}{��}$CH3CH2OH��
��Ϊ�Ҵ��Ĵ�������Ӧ����Ӧ����ʽΪ2 CH3CH2OH+O2$��_{��}^{Cu}$2 CH3CHO+2H2O��
��CH3COOH��CH3CH2OH��Ũ���������¼��ȷ���������Ӧ����CH3COOCH2CH3��
��Ӧ�Ļ�ѧ����ʽΪCH3COOH+CH3CH2OH$?_{��}^{Ũ����}$CH3COOCH2CH3+H2O��
�ʴ�Ϊ��CH2=CH2+H2O$\stackrel{һ������}{��}$CH3CH2OH��2 CH3CH2OH+O2$��_{��}^{Cu}$2 CH3CHO+2H2O��CH3COOH+CH3CH2OH$?_{��}^{Ũ����}$CH3COOCH2CH3+H2O��
��5��46g�Ҵ�Ϊ1mol��1mol C2H5OH��l����ȫȼ������CO2��g����H2O��l�����ų�1366.8KJ��������ע���ʾۼ�״̬�Ͷ�Ӧ��Ӧ�ʱ�д���Ȼ�ѧ����ʽΪ��
C2H5OH��l��+3O2��g��=2CO2��g��+3H2O��l����H=-1366.8KJ/mol��
�ʴ�Ϊ��C2H5OH��l��+3O2��g��=2CO2��g��+3H2O��l����H=-1366.8KJ/mol��
���� ���⿼���л����ƶϣ�Ϊ��Ƶ���㣬�漰ϩ��������ȩ�����ᡢ��֮���ת������ȷ�����ż������ʹ�ϵ�ǽⱾ��ؼ���֪��������Ӧ���͡���Ӧ��������Ŀ�ѶȲ���



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ���������У���1 mol CuFeS2��ȡ1 mol Cuʱ������2 mol O2 | |
| B�� | ұ�������е�β�������������� | |
| C�� | �ڷ�Ӧ2Cu2O+Cu2S=6Cu+SO2���У�ֻ��Cu2O�������� | |
| D�� | ��⾫��ͭ�Ĺ����У�ÿת��1 mol����ʱ�������ܽ�ͭ������Ϊ32 g |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ���������ˮ����ļ��ԣ�Y��Z | B�� | ����̬�⻯������ȶ��ԣ�X��W | ||
| C�� | �����ӵİ뾶��Y��X | D�� | X�ֱ���Z��W�γɻ�������۵㣺Z��W |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
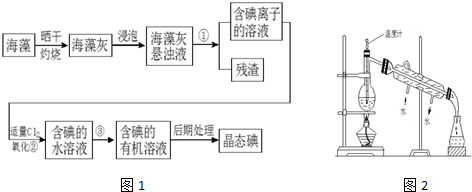
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| ��� ���� | �� | �� | �� | �� | �� | �� | �� | �� | |
| ԭ�Ӱ뾶��10-10m�� | 0.74 | 1.60 | 1.52 | 1.10 | 0.99 | 1.86 | 0.75 | 0.89 | |
| �� Ҫ �� �� �� | ��� | +2 | +1 | +5 | +7 | +1 | +5 | +2 | |
| ��ͼ� | -2 | -3 | -1 | -3 | |||||
| A�� | �ۺ͢ޡ��ܺ͢߷ֱ���ͬһ���� | |
| B�� | Ԫ�آܴ��ڵ�3���ڢ�A�� | |
| C�� | Ԫ�آ�Ӧ������������ǿ�� | |
| D�� | Ԫ�آ���Ԫ�آ��γɵĻ������в����ܴ��ڹ��ۼ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
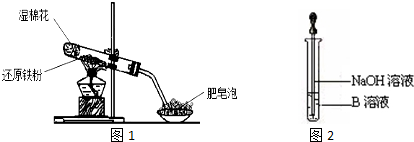
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com