
【题目】有机物分枝酸结构简式如图,分枝酸可用于生化研究。下列关于分枝酸的叙述正确的是
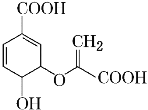
A.分子中含有3种官能团
B.1mol分枝酸最多可与3 mol NaOH发生中和反应
C.可与乙醇、乙酸反应,且反应类型不相同
D.可使溴的四氯化碳溶液、酸性高锰酸钾溶液褪色,且原理不相同
 海淀黄冈名师导航系列答案
海淀黄冈名师导航系列答案 普通高中同步练习册系列答案
普通高中同步练习册系列答案科目:高中化学 来源: 题型:
【题目】钾长石的主要成分为硅酸盐,由前20号元素中的四种组成,化学式为![]() 其中,只有W显负价.X、Y的最外层电子数之和与Z的最高正价数相等.
其中,只有W显负价.X、Y的最外层电子数之和与Z的最高正价数相等.![]() 与W的阴离子具有相同的电子层结构.X、W的质子数之和等于Y、Z的质子数之和.下列说法错误的是
与W的阴离子具有相同的电子层结构.X、W的质子数之和等于Y、Z的质子数之和.下列说法错误的是![]()
A.W的离子半径![]() 的离子半径
的离子半径
B.Z的氢化物稳定性![]() 的氢化物稳定性
的氢化物稳定性
C.Y的氧化物既能与盐酸,又能与NaOH溶液反应
D.![]() 、
、![]() 两种化合物含有的化学键类型完全相同
两种化合物含有的化学键类型完全相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某校化学实验兴趣小组为了探究在实验室制备Cl2的过程中有水蒸气和HCl挥发出来,同时证明氯气的某些性质,甲同学设计了如图所示的实验装置(支撑用的铁架台省略),按要求回答问题(Cl2易溶于CCl4)。
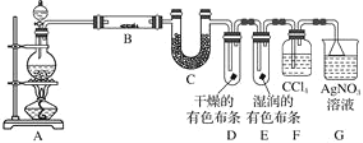
(1)若用含有7.3 g HCl的浓盐酸与足量的MnO2反应制Cl2,制得的Cl2质量总是小于3.55 g的原因是________________________________。
(2)①装置B中盛放的试剂名称为________________,作用是________________________________,现象是_____________________________。
②装置D和E中出现的不同现象说明的问题是___________________。
③装置F的作用是__________________________________________。
(3)乙同学认为甲同学的实验有缺陷,不能确保最终通入AgNO3溶液中的气体只有一种。为了确保实验结论的可靠性,证明最终通入AgNO3溶液的气体只有一种,乙同学提出在某两个装置之间再加一个装置。你认为该装置应加在________与________之间(填装置字母序号),装置中应放入________(填写试剂或用品名称)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化亚铜(CuCl)是白色粉末,微溶于水,酸性条件下不稳定,易生成金属 Cu 和Cu2+,广泛应用于化工和印染等行业。某研究性学习小组拟热分解 CuC122H2O 制备 CuCl,并进行相关探究。下列说法不正确的是( )
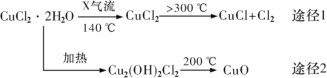
A.途径 1 中产生的Cl2 可以回收循环利用
B.途径 2 中 200℃时反应的化学方程式为:Cu2(OH)2Cl2![]() 2CuO+2HCl↑
2CuO+2HCl↑
C.X 气体是HCl,目的是抑制 CuCl22H2O 加热过程可能的水解
D.CuCl 与稀硫酸反应的离子方程式为:2CuCl+4H++SO42—=2Cu2++2Cl—+SO2↑+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验题:Ⅰ.下列实验设计或操作合理的是____________。
A.在催化剂存在的条件下,苯和溴水发生反应可生成无色比水重的液体溴苯
B.只用水就能鉴别苯、硝基苯、乙醇
C.实验室制取乙烯时温度计的水银球在反应液上方
D.将10滴溴乙烷加入1 mL10%的烧碱溶液中加热片刻后,再滴加2滴2%的硝酸银溶液,以检验水解生成的溴离子
E.工业酒精制取无水酒精时先加生石灰然后蒸馏,蒸馏必须将温度计的水银球插入反应液中,测定反应液的温度
F.苯酚中滴加少量的稀溴水,可用来定量检验苯酚
G.将铜丝弯成螺旋状,在酒精灯上加热变黑后,立即伸入盛有无水乙醇的试管中,完成乙醇氧化为乙醛的实验
Ⅱ.学习卤代烃的性质时,张老师通过实验的方法验证溴乙烷在不同溶剂中与NaOH 反应生成不同的反应产物,请你一起参与他们的探究。
(1)张老师用如图所示装置进行实验:该实验的目的是__________;课上你所观察到的现象是_____;盛水试管(装置)的作用是________。
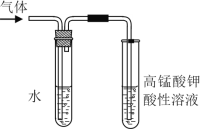
(2)若你用另一实验来达到张老师演示实验的目的,你设计的实验方案依据的反应原理是________(用化学方程式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】主族元素X、Y、Z、W的原子序数依次增加,且均不大于20,X的单质是手机电池重要的电极材料;常温下,Y的两种气态氧化物之间可发生可逆反应;X、Y、W最外层电子数之和与Z的最外层电子数相等;W能形成多种氧化物。下列说法正确的是
A.常温下,Z的单质与Y的简单氢化物相遇,可能产生白烟
B.Z非金属性强于Y,其对应含氧酸的酸性:Z>Y
C.原子半径:X>Y;简单离子半径:Z<W
D.X、W的单质均为活泼金属,通常保存在煤油中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2017年南京理工大学合成出下图的离子化合物,该物质由两种阳离子和两种阴离子构成,其中有两种10电子离子和一种18电子离子。X、Y、Z、M均为短周期元素,且均不在同一族。下列说法不正确的是
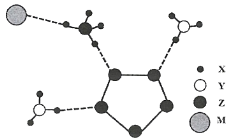
A.X与Y形成的化合物沸点高于Y同族元素与X形成的化合物
B.Z的最高价氧化物对应水化物的酸性比M的强
C.Y气态氢化物的稳定性比Z的强
D.在该盐中,存在极性共价键和非极性共价键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某二元弱碱B(OH)2(K1=5.9×10-2、K2=6.4×10-5)。向10mL稀B(OH)2溶液中滴加等浓度盐酸溶液,B(OH)2、B(OH)+、B2+的浓度分数δ随溶液POH[POH=-lgc(OH)-]变化的关系如图,以下说法正确的是
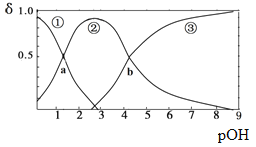
A. 交点a处对应加入的盐酸溶液的体积为5mL
B. 当加入的盐酸溶液的体积为10mL时存在c(Cl-)>c(B(OH)+)>c(H+)>c(OH-)>c(B2+)
C. 交点b处c(OH)=6.4×10-5
D. 当加入的盐酸溶液的体积为15mL时存在:c(Cl-)+c(OH-)= c(B2+)+c(B(OH)+)+ c(H+),
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组设计了如图装置,该装置能制取Cl2,并进行相关性质实验,且可利用装置G储存多余的氯气。
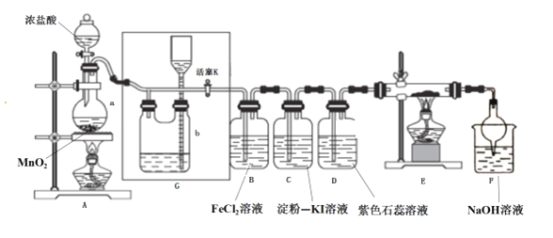
(1)A中发生反应的化学反应方程式为________________________________
(2)实验开始时,先打开分液漏斗旋塞和活塞K,点燃A处酒精灯,让氯气充满整个装置,再点燃E处酒精灯,回答下列问题:
①在装置D中能看到的实验现象分别是 ___________________ ;
②在装置E的硬质玻璃管内盛有碳粉,发生氧化还原反应,产物为CO2和HCl,则E中发生反应的化学方程式为______________________________;
③装置F中球形干燥管的作用是____________________________;
(3)储气瓶b内盛放的试剂是______________________________;
(4)B处发生反应的离子方程式为___________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com