
许多硫的含氧酸盐在医药、化工等方面有着重要的用途。
(1))重晶石(BaS04)常作胃肠道造影剂。
已知:常温下,Ksp(BaSO4)=1.1×10-10,向BaSO4悬浊液中加入硫酸,当溶液的pH=2时, 溶液中 c(Ba2+)= 。
(2)硫酸亚铁铵晶体[(NH4)2Fe(SO4)2·6H20]常作分析剂。
①检验晶体中含有NH4+的方法为_______。
②等物质的量浓度的四种稀溶液:
a.(NH4)2Fe(SO4)2 b.NH4HSO4 c.(NH4)2SO4 d.(NH4)2SO3
其中C(NH4+)由大到小的顺序为 (填选项字母)。
(3)过二硫酸钾(K2S2O8)常作强氧化剂,Na2S2O3常作还原剂。
①K2S2O8溶液与酸性MnSO4溶液混合,在催化剂作用下,可以观察到溶液变为紫色, 该反应的离子方程式为
②用铂作电极,电解H2SO4和K2SO4的混合溶液可以制备K2S2O8,其阳极的电极反应式为_____ __电解过程中阴极附近溶液的pH将______ (填“增大”、“减小”或“不变”)
③产品中K2S2O8的含量可用碘量法测定。操作步骤为:称取0.3g产品于碘量瓶中,加50 mL水溶解;加入4.000 g KI固体(稍过量),振荡使其充分反应;加入适量醋酸溶液酸化,以______为指示剂,用0.1000 mol·L-1 Na2S2O3标准液滴定至终点(已知:I2+2S2O32-=2I-+S4O62-)。重复2次,测得平均消耗标准液21.00mL。该产品中K2S2O8的质量分数为(杂质不参加反应) (列式并计算)。
(1)2.2×10-8 mol/L (2分)
(2)① 取少量晶体,加水溶解,再加入足量NaOH浓溶液加热,生成能使湿润的红色石蕊试纸变蓝的气体,则有NH4+。(其它合理答案也给分) (2分)
② a>c>d>b (2分,写成a c d b 或b<d<c<a也可给分,但写成b d c a不给分)
(3)① 5S2O82-+2Mn2++8H2O催化剂10SO42-+2MnO4-+16H+ (2分)
② 2SO42- -2e-=S2O82-(或2HSO4- -2e- = S2O82-+2H+) (2分)
增大 (1分)
③淀粉 (1分)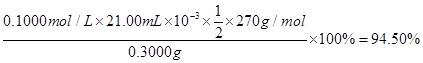
(3分,列式2分,结果1分。列式中不带单位不扣分,写成94.5%亦不扣分。)
解析试题分析:(1)pH=2时,c(SO42-)=0.5×10-2mol/L,Ksp(BaSO4)=c(Ba2+)·c(SO42-)=1.1×10-10,则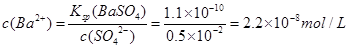 。
。
(2)①NH4+的检验通常是加碱,使其转化为氨气,用湿润的石蕊试纸检验氨气。
②NH4+是弱碱阳离子,在水中可水解使溶液显酸性。a中NH4+与Fe2+的水解相互抑制,c中NH4+正常水解,d中NH4+与SO32-水解相互促进,因此c(NH4+)由大到小为a>c>d。因a、c、d分子中都有2个铵根离子,而b分子中只有1个铵根离子,水解毕竟是微弱的,因此b中的c(NH4+)最小,故整体顺序为a>c>d>b。
(3)①溶液变紫色说明有高猛酸根生成,过二硫酸根被还原为硫酸根。
②电解时,阴离子在阳极失电子,故电极反应式为2SO42- -2e-=S2O82-。阴极阳离子得电子,发生反应为2H++2e—=H2↑,氢离子减少溶液酸性减弱,pH升高。
③根据题中所述滴定原理,Na2S2O3标准液用来滴定碘单质,碘遇淀粉变蓝,因此用淀粉作指示剂。
滴定时发生的反应有:S2O82—+2I—=2SO42—+I2,I2+2S2O32-=2I-+S4O62-,则有S2O82—~2S2O32-,因此产品中K2S2O8的质量为0.1000×21×10-3×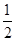 ×270=0.2835g,产品中K2S2O8的质量分数为
×270=0.2835g,产品中K2S2O8的质量分数为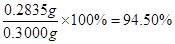 。
。
考点:考查溶度积的计算,盐类的水解,离子检验,电解池原理,中和滴定原理。


科目:高中化学 来源: 题型:填空题
工业上用电解饱和NaCl溶液的方法来制取NaOH、Cl2和H2,并以它们为原料生产一系列化工产品,称为氯碱工业。
(1)若采用无隔膜法电解冷的食盐水时,Cl2会与NaOH充分接触,导致产物仅是NaClO和H2。无隔膜法电解冷的食盐水相应的离子方程式为 。
(2)氯碱工业耗能高,一种将电解池与燃料电池相组合的新工艺可以节(电)能30%以上。在这种工艺设计中,相关物料的传输与转化关系如下图所示,其中的电极未标出,所用的离子膜都只允许阳离子通过。
①经精制的饱和NaCl溶液应从图中电解池的 (填写“左” 或“右”)池注入。
②图中X是____ __(填化学式);乙中右室的电极反应式为: _ ,图示中氢氧化钠溶液质量分数a%与b%的关系是 (填字母)。
A. a%=b% B. a%﹥b% C. a%﹤b%
③甲中的离子交换膜为 (填“阳离子交换膜”或“阴离子交换膜”)。
(3)氯碱工业的产物NaOH与不同物质反应可以生成不同的盐。已知常温下,浓度均为0.1 mol/L的4种钠盐溶液pH如下表:
| 溶质 | Na2CO3 | NaHCO3 | NaClO | NaHSO3 |
| pH | 11.6 | 9.7 | 10.3 | 5.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
水体中重金属铅的污染问题备受关注。水溶液中铅的存在形态主要有Pb2+、Pb(OH)+、Pb(OH)2、Pb(OH)3-、Pb(OH)42-,各形态的浓度分数α随溶液pH变化的关系如下图所示: 
(1)Pb(NO3)2溶液中, ________2(填“>”“=”或“<”);往该溶液中滴入氯化铵溶液后,
________2(填“>”“=”或“<”);往该溶液中滴入氯化铵溶液后, 增加,可能的原因是________________________________。
增加,可能的原因是________________________________。
(2)往Pb(NO3)2溶液中滴入稀NaOH溶液,pH=8时溶液中存在的阳离子(Na+除外)有__________,pH=9时主要反应的离子方程式为_______________________。
(3)某课题组制备了一种新型脱铅剂,能有效去除水中的痕量铅,实验结果如下表:
| 离子 | Pb2+ | Ca2+ | Fe3+ | Mn2+ | Cl- |
| 处理前浓度/(mg·L-1) | 0.100 | 29.8 | 0.120 | 0.087 | 51.9 |
| 处理后浓度/(mg·L-1) | 0.004 | 22.6 | 0.040 | 0.053 | 49.8 |
 E2Pb(s)+2H+则脱铅的最合适pH范围为( )
E2Pb(s)+2H+则脱铅的最合适pH范围为( )查看答案和解析>>
科目:高中化学 来源: 题型:填空题
硫化钠是重要的工业原料。
(1)高温时,等物质的量甲烷与硫酸钠在催化剂作用下恰好完全反应,制得硫化钠。反应的化学方程式为__________________。
(2)甲同学往某Na2S样品(含Na2CO3、Na2SO4杂质)溶液中加人少量BaS溶液,产生白色沉淀,过滤,向滤渣中加人过量盐酸,沉淀完全溶解。由此得出结论:相同温度下,Ksp(BaCO3)<Ksp(BaSO4)。
①沉淀溶于盐酸的离子方程式是__________________。
②仅由上述实验无法判断Ksp(BaCO3)与Ksp(BaSO4)的大小关系,理由是______。
(3)利用Na2S为沉淀剂由锌灰可制得ZnS。锌灰经稀硫酸浸取后所得浸取液含Zn2+、Cd2+、Al3+、Fe2+, Fe3+等,由该浸取液制备ZnS的工艺流程如下图所示。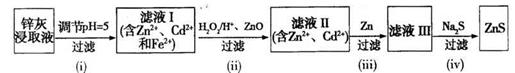
①步骤(i)所得滤渣中含有铝元素的物质为______(填化学式)。
②步骤(ii)所加ZnO的作用为____________。
③步骤(iii)中得到Cd单质的离子方程式为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
重铬酸盐广泛用作氧化剂、皮革制作等。以铬矿石(主要成分是Cr2O3,含FeO、Al2O3、 SiO2等杂质)为原料制取重铬酸钠的流程如下:
请回答下列问题:
(1)写出Cr2O3在高温焙烧时反应的化学方程式______________________
(2)写出硫酸酸化使Na-2CrO4转化为Na2Cr2O7的离子方程式 ______________。
(3)某工厂采用石墨电极电解Na2CrO4溶液,实 现了 Na2CrO4到 Na2Cr2O7的转化,其原理如图所示。
①钠离子交换膜的一种材料是聚丙烯酸钠( ),聚丙烯酸钠单体的结构简式是________;
),聚丙烯酸钠单体的结构简式是________;
②写出阳极的电极反应式__________
(4) Na2Cr2O7可用于测定废水的化学耗氧量(即COD,指每升水样中还原性物质被氧化 所需要O2的质量)。现有某水样100.00 mL,酸化后加入C1 mol/L的Na2Cr2O7溶液 V1 mL,使水中的还原性物质完全被氧化(Cr2O72-还原为Cr3+);再用C2mol/L的FeSO4溶液滴定剩 余的Cr2O72-,结果消耗FeSO4溶液V2 mL。
①该水样的COD为______________mg/L;
②假设上述反应后所得溶液中Fe3+和Cr3+的物质的量浓度均为0.1 mol/L,要使Fe3 +沉 淀完全而Cr3+还未开始沉淀.则需调节溶液pH的范围是 _______.
(可能用到的数据:KSPFe(OH)3=4.0×10-38, KSPCr(OH)3=6.0×10-31,
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
A、B、C、D四种物质溶于水均完全电离,电离出的离子如下表。
| 阳离子 | Na+、Al3+、Ba2+、H+、NH4+ |
| 阴离子 | SO42-、OH-、CO32-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:问答题
(15分)
制烧碱所用盐水需两次精制。第一次精制主要是用沉淀法除去粗盐水中Ca2+、Mg2+、Fe3+、SO42-等离子,过程如下:
Ⅰ. 向粗盐水中加入过量BaCl2溶液,过滤;
Ⅱ. 向所得滤液中加入过量Na2CO3溶液,过滤;
Ⅲ. 滤液用盐酸调节pH,获得一次精制盐水。
(1)过程Ⅰ除去的离子是______。
(2)过程Ⅰ、Ⅱ生成的部分沉淀及其溶解度(20℃/g)如下表:
| CaSO4 | Mg2(OH)2CO3 | CaCO3 | BaSO4 | BaCO3 |
| 2.6×10-2 | 2.5×10-4 | 7.8×10-4 | 2.4×10-4 | 1.7×10-3 |

查看答案和解析>>
科目:高中化学 来源: 题型:计算题
已知在室温时,Mg(OH)2的溶度积Ksp=5.6×10-12 (mol/L)3,要使0.2mol/lMgSO4溶液中的Mg2+沉淀较为完全[c(Mg2+)<5.6×10-6mol/L],则应向溶液中加入NaOH溶液,使溶液的pH最小为多少?
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
实验室用NaOH固体配制0.1 000mol·L-1NaOH溶液500mL.
(1)用托盘天平称取NaOH固体________g.溶液配制过程用到下列玻璃仪器,按首次使用的先后顺序依次是________ (填仪器选项符号)
A.玻璃棒 B.胶头滴管 C.烧杯 D.500mL容量瓶
(2)用所配制的0.1000mol·L-1NaOH溶液通过中和滴定测定一元弱酸HA溶液浓度,每次滴定取用的HA溶液均为20.00mL,使用酚酞溶液为指示剂,滴定终点的标志是____________________________。滴定的实验数据记录:
| 滴定次数 | NaOH溶液体积(mL) | |
| V1 | V2 | |
| 1 | 3.05 | 44 |
| 2 | 1.45 | 41.5 |
| 3 | 7.65 | 47.6 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com