
【题目】某温度时,BaSO4在水中的沉淀溶解平衡曲线如图所示。已知:p(Ba2+)=-lgc(Ba2+),p(SO42-)=-lgc(SO42-)。下列说法正确的是( )

A. 加入BaCl2可以使溶液由c点变到a点
B. a点的Ksp(BaSO4)小于b点的Ksp(BaSO4)
C. d点表示的是该温度下BaSO4的不饱和溶液
D. 该温度下,Ksp(BaSO4)=1.0×10-24
【答案】A
【解析】BaSO4在水中的沉淀溶解平衡:BaSO4(s)![]() Ba2++SO42-,当加入BaCl2时,平衡向逆向移动,c(Ba2+)增大,p(Ba2+)减小,c(SO42-)减小,p(SO42-)增大,故加入BaCl2可以使溶液由c点变到a点,A项正确;Ksp是温度的函数,温度未变,Ksp(BaSO4)不变,B项错误;d点时:c(SO42-)×c(Ba2+)> Ksp(BaSO4),说明d点表示的是该温度下BaSO4的饱和溶液,C项错误;根据a点可知:p(SO42-)=6,即c(SO42-)=10-6mol/L,p(Ba2+)=4,c(Ba2+)=10-4mol/L,Ksp(BaSO4)=c(SO42-)×c(Ba2+)=1×10-10,D项错误。
Ba2++SO42-,当加入BaCl2时,平衡向逆向移动,c(Ba2+)增大,p(Ba2+)减小,c(SO42-)减小,p(SO42-)增大,故加入BaCl2可以使溶液由c点变到a点,A项正确;Ksp是温度的函数,温度未变,Ksp(BaSO4)不变,B项错误;d点时:c(SO42-)×c(Ba2+)> Ksp(BaSO4),说明d点表示的是该温度下BaSO4的饱和溶液,C项错误;根据a点可知:p(SO42-)=6,即c(SO42-)=10-6mol/L,p(Ba2+)=4,c(Ba2+)=10-4mol/L,Ksp(BaSO4)=c(SO42-)×c(Ba2+)=1×10-10,D项错误。


科目:高中化学 来源: 题型:
【题目】下列实验操作正确的是( ) ①用50mL量筒量取5.2mL稀硫酸;
②用分液漏斗分离苯和四氯化碳的混合物
③用托盘天平称量17.7g氯化钠晶体
④向小试管中加入100ml稀盐酸.
A.①②
B.②③
C.③
D.②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积固定的密闭容器中,对于反应2SO2(g)+O2(g)![]() 2SO3(g)ΔH<0。下列判断正确的是 ( )
2SO3(g)ΔH<0。下列判断正确的是 ( )
A. 增大反应体系的压强,平衡后SO2的浓度、转化率、体积分数都增加
B. 当单位时间内消耗SO2的物质的量和生成SO3的物质的量相同时,反应达到平衡状态
C. 升高温度,平衡向左移动
D. 充入SO3气体,体系压强增大,平衡向右移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,Fe(OH)3(s)、Cu(OH)2(s)分别在溶液中达到沉淀溶解平衡后,改变溶液pH,金属阳离子浓度变化如图所示。据图分析,下列判断正确的是

A. [Ksp[Cu(OH)2]<Ksp[Fe(OH)3]
B. d点代表的溶液中Fe(OH)3已过饱和、Cu(OH)2未饱和
C. 加适量NH4Cl固体可使溶液由a点变到b点
D. b、c两点代表的Fe(OH)3、Cu(OH)2溶解度相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了探究一氧化氮、二氧化氮、硝酸之间的相互转化,有同学设计了如下实验:如图将少量铜片装入小试管中,再加人适量稀硝酸,然后迅速将大试管倒扣在小试管外。将套好的大、小试管一起竖立在烧杯中,使水浸没大试管口。充分反应完后,通过弯玻璃管往大试管中吹人足量空气,并往烧杯中滴人几滴紫色石蕊试液。试回答:
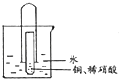
(1)写出铜片溶于稀硝酸的离子方程式________。
(2)吹入空气前小试管中的现象是铜片逐渐溶解.溶液变蓝色及________。
(3)假设小试管中加入了 0.192g铜片和5ml浓度为2mol/L的稀硝酸,则充分反应后小试管内溶 液中NO ![]() 物质的量浓度为________mol/L(忽略溶液体积变化)。
物质的量浓度为________mol/L(忽略溶液体积变化)。
(4)若将水换成氢氧化钠溶液,实验过程中生成的一种红棕色气体会与它发生反应,生成两种钠盐和水,且氧化产物与还原产物的物质的量相等,试写出该反应的离子方程式________。
(5)将等质里的铜片分别与等体积过量的浓、稀硝酸反应(假设溶液体积不变 所得溶液前者呈绿色,后者呈蓝色。某同学认为可能是Cu2+浓度的差异引起的,你认为是否正确?________(填“正确”或“不正确”),理由是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】TiO2是一种性能优良的半导体光催化剂,能有效地吸附有机污染物(如甲醛、甲苯等)和含氮化合物(如NH3、CN-等)转化为CO2和N2等小分子物质。
(1)Ti基态核外电子排布式为________________。
(2)甲醛HCHO分子空间构型为_____;分子中碳原子轨道杂化类型为_____,π键和σ键的个数之比为____,
(3)氨气极易溶于水,是因为氨和水的分子均是_________,还因为___________。
(4)甲苯分子中能够共平面的原子最多为____个;苯环不易被卤素加成,而比较容易被卤素取代苯环上的氢,原因是___________________。
(5)含CN-的污水毒性极大,用NaClO先把CN-氧化为CNO-,然后在酸性条件下再将CNO-氧化为无污染的气体。请写出与CNO-互为等电子体的微粒______分子或离子,写一种)。
(6)Ti[(CN)4]2-中Ti2+与CN-的C原子形成配位键。不考虑空间构型,Ti[(CN)4]2-的结构可表示为_____________________。
(7)Ti的某氧化物和CaO相互作用能形成钛酸盐的晶胞结构如图所示(Ti4+位于立方体的顶点,Ca2+ 处于立方体的中心)。该晶体中,Ti4+和周围____ 个O2-相紧邻;若该晶胞的密度为dg/cm3则钛氧键的键长为______pm (用带NA的代数式表示)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
A. 用托盘天平直接称量烧碱4.0g
B. 在蒸发皿中灼烧CuSO4·5H2O晶体以除去结晶水
C. 用标准盐酸溶液滴定未知浓度的氨水,用酚酞作指示剂
D. 配制0.9%的氯化钠溶液时,将称量的氯化钠放入烧杯中加计量的水搅拌溶解
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,在甲、乙、丙、丁四个恒容密闭容器中投入H2和I2,发生反应:H2(g)+I2(g)![]() 2HI(g)。反应体系中各物质浓度的有关数据如下。
2HI(g)。反应体系中各物质浓度的有关数据如下。
容器 | 起始浓度 | 平衡浓度 | |
c(H2)/mol·L-1 | c(I2)/mol·L-1 | c(HI)/mol·L-1 | |
甲 | 0.01 | 0.01 | 0.004 |
乙 | 0.01 | 0.02 | a |
丙 | 0.02 | 0.01 | b |
丁 | 0.02 | 0.02 | —— |
下列判断正确的是
A. H2的平衡浓度:a=b>0.004 B. 平衡时,H2的转化率:丁>甲
C. 平衡时,乙中H2的转化率等于20% D. 丙中条件下,该反应的平衡常数K=4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质分类的正确组合是( )
碱 | 酸 | 盐 | 酸性氧化物 | 碱性氧化物 | |
A | Na2CO3 | H2SO4 | NaOH | CO2 | SO2 |
B | NaOH | HCl | NaCl | CO | Na2O |
C | NaOH | CH3COOH | CaF2 | SO2 | CO |
D | KOH | HNO3 | CaCO3 | SO3 | CaO |
A.AB.BC.CD.D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com