
【题目】海水晒盐可制得粗盐,粗盐除氯化钠外,还含有MgCl2、CaCl2、Na2SO4以及泥沙等杂质,以下是某化学兴趣小组制定的一套制备精盐的实验方案,步骤如图所示:

【査阅资料】可溶性钡盐有剧毒,可以导致蛋白质变性,破坏体内各种酶,使一系列生理活动被破坏。
【交流与表达】
(1)步驟①中玻璃棒的作用是________,溶解粗盐时所加水的质量不宜过多,也不宜过少,过多则蒸发时浪费燃料并且耗时长,过少会使得精盐的产率________(填"偏高"或“偏低”);
(2)下列试剂X符合要求的是_______ (选填字母)。
A、氧化钙 B、氢氧化钡溶液 C、氢氧化钠溶液 D、氢氧化钙溶液 E、氢氧化钾溶液
(3)氯化钡溶液和碳酸钠溶液的添加顺序_______(填“能”或“不能”)颠倒,沉淀B中的成分是BaSO4和_______(填化学式)。
(4)进行操作③后,下列判断Na2CO3过量的方法正确的是_______ (选填字母)。
A、 取少量滤液B,滴加酚酞,若变为红色,说明Na2CO3过量
B、 取少量滤液B,滴加足量稀盐酸,若有气泡产生,说明Na2CO3过量
C、 取少量滤液B,滴加氣化钡溶液,若有白色沉淀产生,说明Na2CO3过量
(5)某同学为了证明溶液C是否有盐酸剩余,设计的下列方法中正确的是_______(选填宇母)。
A、 取样,加入铜,若无现象,说明盐酸没有剩余
B、 取样,测溶液pH,若PH<7,说明盐酸有剩余
C、 取样,加碳酸钠溶液,若有气泡产生,说明有盐酸剩余
D、 取样,滴入酚酞溶液,若溶液呈无色,说明盐酸有剩余
E、 取样,加硝酸银溶液,若有白色沉淀产生,说明有盐酸剩余
【反思与评价】(6)小刚同学认为该方案实际得到的氯化钠比原粗盐中含有的氯化钠要多, 请你为他找出理由_______________。
【答案】 加快溶解速率 偏低 ABCD 不能 CaCO3 、BaCO3、Mg(OH)2 BC BC 在提纯过程中反应生成了氯化钠
【解析】(1)步骤①中玻璃棒的作用是加快溶解速率;溶解粗盐时所加水的质量不宜过多,也不宜过少,过多时,蒸发时浪费燃料并且耗时长,也不宜过少,过少时会导致氯化钠不能完全溶解,导致精盐的产率偏低;(2)A、氧化钙和水反应生成氢氧化钙,氢氧化钙能和氯化镁反应生成氢氧化镁沉淀和氯化钙,因此X可以是氧化钙,A正确; B、氢氧化钡和氯化镁反应生成氢氧化镁沉淀和氯化钡,因此X可以是氢氧化钡溶液,B正确; C、氢氧化钠和氯化镁反应生成氢氧化镁沉淀和氯化钠,因此X可以是氢氧化钠溶液,C正确; D、氢氧化钙能和氯化镁反应生成氢氧化镁沉淀和氯化钙,因此X可以是氢氧化钙溶液,D正确; E、氢氧化钾和氢氧化镁反应生成氢氧化镁沉淀和氯化钾,和稀盐酸反应生成氯化钾和水,X是氢氧化钾溶液时会带入杂质氯化钾,因此X不能是氢氧化钾溶液,E错误,答案选ABCD;(3)氯化钡溶液和碳酸钠溶液的添加顺序不能颠倒,这是因为颠倒后不能除去过量的氯化钡;根据以上分析可知沉淀B中的成分是BaSO4、CaCO3和BaCO3、Mg(OH)2。(4)A、取少量滤液B,滴加酚酞,若变为红色,不能说明Na2CO3过量,这是因为溶液中含有氢氧化钠,氢氧化钠溶液能使酚酞试液变红色,A错误;B、取少量滤液B,滴加足量稀盐酸,若有气泡产生,说明Na2CO3过量;C、取少量滤液B,滴加氯化钡溶液,若有白色沉淀产生,说明Na2CO3过量,答案选BC;(5)A、取样,加入铜,若无现象,不能说明盐酸没有剩余,这是因为铜不能和稀盐酸反应,A错误;B、取样,测溶液pH,若pH<7,说明盐酸有剩余,B正确;C、取样,加碳酸钠溶液,若有气泡产生,说明有盐酸剩余,C正确;D、取样,滴入酚酞溶液,若溶液呈无色,不能说明盐酸没有剩余,这是因为盐酸显酸性,不能使酚酞试液变色,D错误;E、取样,加硝酸银溶液,若有白色沉淀产生,不能说明有盐酸剩余,这是因为氯化钠能和硝酸银反应生成白色沉淀氯化银,E错误,答案选BC;(6)该方案实际得到的氯化钠比原粗盐中含有的氯化钠要多,折是因为反应中生成了氯化钠。


科目:高中化学 来源: 题型:
【题目】T℃时,在20.00 mL 0.10 mol·L-1CH3COOH溶液中滴入0.10 mol·L-1 NaOH溶液,溶液pH与NaOH溶液体积关系如图所示。下列说法正确的是

A. T℃时,CH3COOH电离平衡常数Ka=1.0×10-3
B. M点对应的NaOH溶液体积为20.0 mL
C. N点与Q点所示溶液中水的电离程度:N>Q
D. N点所示溶液中c(Na+)>c(OH-)>c(CH3COO-)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学家们合成了如下图所示的一系列的星烷,如三星烷、四星烷、五星烷等。下列说法正确的是

A. 它们之间互为同系物
B. n星烷的化学式为C3nH4n(n为大于等于3的自然数)
C. 四星烷与![]() 互为同分异构体
互为同分异构体
D. 它们的一氯代物均只有两种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,向纯水中通入Cl2至饱和,再逐滴滴加0.1mol/L的NaOH溶液,实验过程中得到如下图所示的pH变化曲线。下列有关说法正确的是
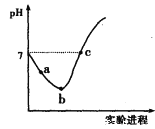
A. pH=7时,一定有c(Na+)=c(Cl-)+c(ClO-)
B. 从a点到b点,Cl2在水中的溶解度增大
C. b点溶液中:c(H+)=c(Cl-)+c(OH-)+c(HClO)
D. 从b点到c点,溶液中![]() 减小
减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室中用如图所示的原电池装置做电源电解足量的NaC1的酚酞溶液,X、Y均为惰性电极。下列有关说法不正确的是
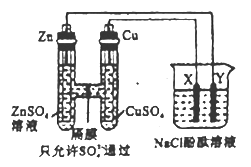
A. 原电池中SO42-通过隔膜从左向右移动
B. 反应一段时间后,烧杯中Y电极附近变红
C. Zn极质量减少6.5g时,X极理论上生成气体2.24L(标准状况)
D. 室温下,若Cu极质量增加1.6g时,此时烧杯溶液体积为500mL,则溶液的pH为13
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙、丙三种物质是某抗生素合成过程中的中间产物,下列说法正确的是

A. 甲、乙均能发生加成反应
B. 甲的一种同分异构体中可能含有苯环和羧基
C. 甲分子中的所有原子可能共平面
D. 用酸性KMnO4溶液可鉴别乙和丙
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(15分)含苯酚的工业废水的方案如下图所示:

回答下列问题:
(1)设备①进行的是 操作(填写操作名称),实验室这一步操作所用的仪器是 。
(2)由设备②进入设备③的物质A是 。
(3)在设备③中发生反应的化学方程式为 。
(4)在设备④中,物质B的水溶液和CaO反应,产物是CaCO3、 和水,再通过过滤得产物。
(5)上图中,能循环使用的物质是C6H6、CaO、NaOH水溶液、 。
(6)写出同时满足下列条件的苯酚的一种同分异构体的结构简式是 。
①核磁共振氢谱只有一个峰
②分子中无碳碳双键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锰的单质及其化合物的用途非常广泛.回答下列问题:
(1)基态锰原子的核外电子排布式为_______,其d轨道中未成对电子数为__________.
(2)MnO的熔点(1650℃)比MnS的熔点(1610℃)高,它们都属于___晶体。前者熔点较高的原因是_____________。
(3)锰的一种配合物的化学式为Mn(BH4)2(THF)3,THF的结构简式如图所示。

① 与Mn2+形成配位键的原子为_______(填元素符号)。
② BH4-的空间构型为_______,其中B原子的杂化轨道类型为________。
③ 写出两种与BH4-互为等电子体的分子或离子:___________。
(4)一种磁性材料的单晶胞结构如图所示。

① 该晶胞中碳原子的原子坐标为________。
② Mn在晶体中的堆积方式为________(填“简单立方”“体心立方”“面心立方最密”或“六方最密") 堆积。
③ 若该晶胞的边长为a pm,NA表示阿伏加德罗常数的数值,则该晶体密度的表达式为ρ=_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(一)硫是一种重要的非金属元素,在自然界中以游离态和多种化合态形式存在。其中二氧化硫是主要的大气污染物之一。完成下列填空:
⑴火法炼铜中有如下反应:
Ⅰ:2Cu2S(s)+3O2(g)=2Cu2O(s)+2SO2(g) ΔH =-768.2 kJ·mol—1
Ⅱ:2Cu2O(s)+ Cu2S(s)=6Cu(s)+SO2(g) ΔH = +116.0 kJ·mol—1
①在反应Ⅱ中,只作氧化剂的是_________________(用化学式表示)。
②反应Cu2S(s)+O2(g)=2Cu(s)+SO2(g)的ΔH=______________________。
⑵工业上用过硫酸钾(K2S2O8)测定钢铁中的锰含量,配平下列反应式:
______Mn2++______S2O82-+_____H2O = ______MnO4-+______SO42-+_____H+
⑶将SO2通入氯酸溶液中生成一种强酸和一种氧化物,已知反应掉1.5mol氯酸时转移了9.03×1023个电子,写出该反应的化学方程式_______________________________。
(二)为有效控制雾霾,各地积极采取措施改善大气质量,有效控制空气中氮氧化物、碳氧化物和硫氧化物显得尤为重要。
⑴已知2NO(g)+2CO(g)=N2(g)+2CO2(g)△H=-476.5kJ·mol-1;
将0.20molNO和0.10molCO充入一个容积为1L的密闭容器中,反应过程中物质浓度变化如图所示。

①CO在0-9min内的平均反应速率v(CO)=_______mol·L-1·min-1 (保留两位有效数字);第12 min时改变的反应条件可能为________。
A.升高温度 B.加入NO C.加催化剂 D.降低温度
②该反应在第18 min时达到平衡状态,CO2的体积分数为________(保留三位有效数字),化学平衡常数K=________(保留两位有效数字)。
⑵通过人工光合作用能将水与燃煤产生的CO2转化成HCOOH和O2。已知常温下0.1mol·L-1的HCOONa溶液pH=10,则HCOOH的电离常数Ka=______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com