
【题目】(一)硫是一种重要的非金属元素,在自然界中以游离态和多种化合态形式存在。其中二氧化硫是主要的大气污染物之一。完成下列填空:
⑴火法炼铜中有如下反应:
Ⅰ:2Cu2S(s)+3O2(g)=2Cu2O(s)+2SO2(g) ΔH =-768.2 kJ·mol—1
Ⅱ:2Cu2O(s)+ Cu2S(s)=6Cu(s)+SO2(g) ΔH = +116.0 kJ·mol—1
①在反应Ⅱ中,只作氧化剂的是_________________(用化学式表示)。
②反应Cu2S(s)+O2(g)=2Cu(s)+SO2(g)的ΔH=______________________。
⑵工业上用过硫酸钾(K2S2O8)测定钢铁中的锰含量,配平下列反应式:
______Mn2++______S2O82-+_____H2O = ______MnO4-+______SO42-+_____H+
⑶将SO2通入氯酸溶液中生成一种强酸和一种氧化物,已知反应掉1.5mol氯酸时转移了9.03×1023个电子,写出该反应的化学方程式_______________________________。
(二)为有效控制雾霾,各地积极采取措施改善大气质量,有效控制空气中氮氧化物、碳氧化物和硫氧化物显得尤为重要。
⑴已知2NO(g)+2CO(g)=N2(g)+2CO2(g)△H=-476.5kJ·mol-1;
将0.20molNO和0.10molCO充入一个容积为1L的密闭容器中,反应过程中物质浓度变化如图所示。

①CO在0-9min内的平均反应速率v(CO)=_______mol·L-1·min-1 (保留两位有效数字);第12 min时改变的反应条件可能为________。
A.升高温度 B.加入NO C.加催化剂 D.降低温度
②该反应在第18 min时达到平衡状态,CO2的体积分数为________(保留三位有效数字),化学平衡常数K=________(保留两位有效数字)。
⑵通过人工光合作用能将水与燃煤产生的CO2转化成HCOOH和O2。已知常温下0.1mol·L-1的HCOONa溶液pH=10,则HCOOH的电离常数Ka=______________。
【答案】 Cu2O -217.4 kJ·mol—1 2 5 8 2 10 16 SO2+2HClO3=H2SO4+2ClO2 4.4×l0-3 D 22.2% 3.4 1.0×l0-7
【解析】(一)(1)①考查氧化还原反应中的概念,根据反应方程式II,Cu2O中只有Cu的化合价由-1价→0价,化合价降低,Cu2O只作氧化剂,Cu2S中Cu+1价→0价,化合价降低,作氧化剂,S的化合价由-2价→+4价,化合价升高,作还原剂,因此Cu2S既是氧化剂又是还原剂;②考查热化学反应方程式的计算,(I+II)/3得出△H=(-768.2+116)/3kJ·mol-1=-217.4kJ·mol-1;(2)考查氧化还原反应方程式的配平,S2O82-中S显+6价,S2O82-中一个过氧键,因此S2O82-化合价降低2价,Mn2+的化合价升高5价,最小公倍数为10,即Mn2+的系数为2,S2O82-的系数为5,然后根据电荷守恒和原子守恒,配平其他,即2Mn2++5S2O82-+8H2O=2MnO4-+10SO42-+16H+;(3)考查转移电子数目的计算,根据信息,利用HClO3的氧化性,把SO2氧化成SO42-,令氯酸的还原产物中Cl的化合价为x价,因此有1.5×(5-x)=9.03×1023/(6.02×1023),解得x=4,即氧化物是ClO2,因此反应方程式为O2+2HClO3=H2SO4+2ClO2;(二)(1)考查化学反应速率的计算、影响化学平衡移动的因素以及化学平衡计算,①根据化学反应速率的数学表达式,v(CO)=(0.1-0.06)/9mol/(L·min)=4.4×10-3 mol/(L·min);A、根据图像,12min平衡向正反应反应方向移动,因为正反应方向是放热反应,升高温度,平衡向逆反应方向移动,故A错误;B、增加NO的量,NO的浓度应增大,但12min时,NO的浓度仍从原平衡开始,故B错误;C、催化剂对化学平衡无影响,故C错误;D、正反应方向是放热反应,降低温度,平衡向正反应方向移动,故D正确;②2NO(g)+2CO(g)=N2(g)+2CO2(g)
起始浓度:0.2 0.1 0 0
变化浓度:0.06 0.06 0.03 0.06
平衡浓度:0.14 0.04 0.03 0.06 因此CO2的体积分数为0.06/(0.14+0.04+0.03+0.06)×100%=22.2%,根据化学平衡常数的定义,K=[c2(CO2)×c(N2)]/×c(N2)]/[c2(NO)×c2(CO)]=(0.062×0.03)/(0.042×0.142)≈3.4;(2)本题考查三大平衡常数的关系,甲酸钠溶液中c(OH-)=Kw/c(H+)=10-14/10-10mol·L-1=10-4mol·L-1,HCOONa水解平衡常数为Kh=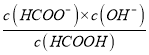 =
=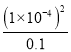 =10-7,三大平衡常数的关系是Kh×Ka=Kw,因此甲酸的电离平衡数Ka=Kw/Kh=10-7。
=10-7,三大平衡常数的关系是Kh×Ka=Kw,因此甲酸的电离平衡数Ka=Kw/Kh=10-7。


科目:高中化学 来源: 题型:
【题目】海水晒盐可制得粗盐,粗盐除氯化钠外,还含有MgCl2、CaCl2、Na2SO4以及泥沙等杂质,以下是某化学兴趣小组制定的一套制备精盐的实验方案,步骤如图所示:

【査阅资料】可溶性钡盐有剧毒,可以导致蛋白质变性,破坏体内各种酶,使一系列生理活动被破坏。
【交流与表达】
(1)步驟①中玻璃棒的作用是________,溶解粗盐时所加水的质量不宜过多,也不宜过少,过多则蒸发时浪费燃料并且耗时长,过少会使得精盐的产率________(填"偏高"或“偏低”);
(2)下列试剂X符合要求的是_______ (选填字母)。
A、氧化钙 B、氢氧化钡溶液 C、氢氧化钠溶液 D、氢氧化钙溶液 E、氢氧化钾溶液
(3)氯化钡溶液和碳酸钠溶液的添加顺序_______(填“能”或“不能”)颠倒,沉淀B中的成分是BaSO4和_______(填化学式)。
(4)进行操作③后,下列判断Na2CO3过量的方法正确的是_______ (选填字母)。
A、 取少量滤液B,滴加酚酞,若变为红色,说明Na2CO3过量
B、 取少量滤液B,滴加足量稀盐酸,若有气泡产生,说明Na2CO3过量
C、 取少量滤液B,滴加氣化钡溶液,若有白色沉淀产生,说明Na2CO3过量
(5)某同学为了证明溶液C是否有盐酸剩余,设计的下列方法中正确的是_______(选填宇母)。
A、 取样,加入铜,若无现象,说明盐酸没有剩余
B、 取样,测溶液pH,若PH<7,说明盐酸有剩余
C、 取样,加碳酸钠溶液,若有气泡产生,说明有盐酸剩余
D、 取样,滴入酚酞溶液,若溶液呈无色,说明盐酸有剩余
E、 取样,加硝酸银溶液,若有白色沉淀产生,说明有盐酸剩余
【反思与评价】(6)小刚同学认为该方案实际得到的氯化钠比原粗盐中含有的氯化钠要多, 请你为他找出理由_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种熔融碳酸盐燃料电池原理示意如图。下列有关该电池的说法正确的是( )

A. 电极A上H2和CO都发生了氧化反应
B. 反应CH4+H2O![]() 3H2+CO,每消耗1molCH4转移12mol电子
3H2+CO,每消耗1molCH4转移12mol电子
C. 电池工作时,电能转变为化学能
D. 电极B上发生的电极反应为:O2+2H2O+4e-=4OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列行为符合安全要求的是
A. 实验室制取氨气时,将尾气直接通入水中吸收
B. 金属钠着火,立即用泡沫灭火器灭火
C. 大量氯气泄漏时,迅速离开现场并尽量往高处去
D. 皮肤上不慎沾上浓NaOH溶液,立即用盐酸冲洗
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中:
①结构片段为…… ……的高聚物,其单体是甲醛和苯酚
……的高聚物,其单体是甲醛和苯酚
②标准状况下,22.4LHF所含电子数约为10NA
③甲醇通常是一种有毒的气体,分子中只含极性键
④苯酚和碳酸钠溶液的反应:![]()
⑤ 的名称为:2,4,4,-三甲基-1-戊烯
的名称为:2,4,4,-三甲基-1-戊烯
⑥3-甲基-1-丁烯中的所有碳原子不可能处于同一平面
⑦等物质的量的苯与苯甲酸完全燃烧消耗氧气的量不相等
其中正确的有( )个。
A. 3 B. 4 C. 5 D. 6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在托盘天平的两盘,放上质量相等的A、B两烧杯,调至平衡,然后分别倒入质量相等的足量盐酸,继而在AB两烧杯中放入下述各组物质,结果天平仍保持平衡的是()
A. 0.5molNa和0.5molMg B. 0.1molZn和0.1molAl
C. 8.4gMgCO3和8.4gNaHCO3 D. 10gCaCO3和10gMgCO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知下列元素的原子半径:根据以下数据,磷原子的半径可能是
原子 | N | S | O | Si |
半径/10-10m | 0.75 | 1.02 | 0.74 | 1.17 |
A.0.80×10-10m B.1.10×10-10m C.1.20×10-10m D.0.70×10-10m
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关溶液组成的描述合理的是
A.无色溶液中可能大量存在Al3+、NH4+、Cl、S2-
B.酸性溶液中可能大量存在Na+、ClO、SO42-、I
C.弱碱性溶液中可能大量存在Na+、K+、Cl、HCO3
D.中性溶液中可能大量存在Fe3+、K+、Cl、SO42
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在室温下,向100mL CuSO4饱和溶液中加入足量的经硫酸酸化的KI溶液,发生如下反应:2Cu2++4I-=2CuI↓+I2,反应完全后,用0.625mol/L的Na2S2O3溶液进行滴定,I2+2S2O32-=2I-+S4O62-,消耗了20 mL Na2S2O3溶液,计算:
(1)原饱和溶液中CuSO4的物质的量浓度;
(2)若CuSO4饱和溶液的密度为1.0 g/cm3,室温时CuSO4的溶解度是多少。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com