
c(OH-)c
| ||
| c(NH3?H2O) |
|
| 1.3×10-2 |
| 2 |
| 1.2×10-11 |
| (10-4)2 |


科目:高中化学 来源: 题型:
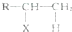 .A、B、C、D、E、M、N有下列转化关系:
.A、B、C、D、E、M、N有下列转化关系: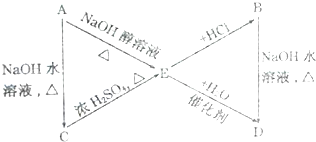
| O2 |
| 新制的Cu(OH)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
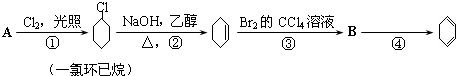
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、K+、MnO4-、SO42-、H2SO3 |
| B、Na+、SiO32-、Cl-、NO3- |
| C、H+、Al3+、SO42-、NH4+ |
| D、Na+、S2-、H+、S2O32- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、AlO2- |
| B、Al3+ |
| C、Mg2+ |
| D、Cu2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
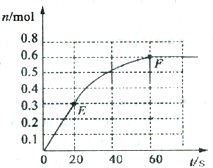 373K时,某1L恒容密闭容器中加入1molNH3,发生如下可逆反应2NH3(g)?N2(g)+3H2(g).其中物质H2的物质的量随时间变化如图所示.
373K时,某1L恒容密闭容器中加入1molNH3,发生如下可逆反应2NH3(g)?N2(g)+3H2(g).其中物质H2的物质的量随时间变化如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、金属单质与盐溶液的反应都是置换反应 |
| B、SO2和CO2都是酸性氧化物,都能与NaOH溶液反应 |
| C、Na2O和Na2O2组成元素相同,与CO2反应产物也完全相同 |
| D、C、N、S三种单质直接与O2反应都能生成两种以上氧化物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
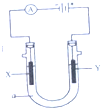 (1)甲醇是一种优质燃料,可制作燃料电池,工业上可用下列两种反应制备甲醇:
(1)甲醇是一种优质燃料,可制作燃料电池,工业上可用下列两种反应制备甲醇:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com