
【题目】有关物质间有如图所示的转化关系。已知B、D、G是常见的金属单质,E为常见的非金属单质,H常温下为无色液体,K为红棕色气体。
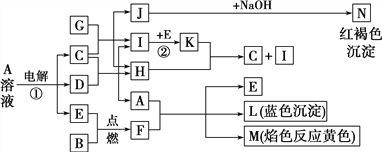
(1)F的电子式为______________,写出其与CO2反应的化学方程式并用双线桥标出电子转移的方向和数目:_________________________________
(2)反应①的离子方程式为____________________________________________。
(3)C与足量G反应的化学方程式为_____________________________________。其中,还原剂与氧化剂的物质的量之比为____________,检验反应中生成的金属离子的试剂为______________。
(4)Al能与A发生置换反应,生成物溶质与Na2CO3不能在溶液中大量共存,用离子方程式表示其原因:__________________________________
(5)I可由某种氢化物催化氧化得到,其反应的化学方程式为_______________________________。
(6)漂白粉和F都应密封保存,写出漂白粉露置于空气中失效的化学方程式:________________________________________________________________________
【答案】 ![]()
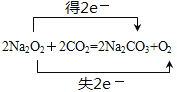 2Cu2++2H2O
2Cu2++2H2O![]() 2Cu+O2↑+4H+ 3Fe+8HNO3(稀)===3Fe(NO3)2+2NO↑+4H2O 3∶2 K3[Fe(CN)6]溶液 2Al3++3CO32-+3H2O=2Al(OH)3↓+3CO2↑ 4NH3+5O2
2Cu+O2↑+4H+ 3Fe+8HNO3(稀)===3Fe(NO3)2+2NO↑+4H2O 3∶2 K3[Fe(CN)6]溶液 2Al3++3CO32-+3H2O=2Al(OH)3↓+3CO2↑ 4NH3+5O2![]() 4NO+6H2O Ca(ClO)2+CO2+H2O===CaCO3↓+2HClO、2HClO
4NO+6H2O Ca(ClO)2+CO2+H2O===CaCO3↓+2HClO、2HClO![]() 2HCl+O2↑
2HCl+O2↑
【解析】A的电解产物反应生成H,H常温下为无色液体,H为H2O;L是蓝色沉淀,为Cu(OH)2,M的焰色反应为黄色,M含有Na元素,由转化关系A+F→E+L+M,可知F与水反应生成碱与E,且B+E→F,故F为Na2O2,E为O2,B为金属Na,A为铜盐,由A溶液 ![]() C+D+E可知,电解产物为三种,为放氧生酸型,电解生成Cu、O2、酸,由I
C+D+E可知,电解产物为三种,为放氧生酸型,电解生成Cu、O2、酸,由I ![]() K可知,K为红棕色气体,K为NO2,I为一氧化氮,NO2与水反应生成硝酸和一氧化氮,则C为硝酸,则A为硝酸铜,N为红褐色沉淀,为氢氧化铁,则J为铁盐,为硝酸铁,G为铁。
K可知,K为红棕色气体,K为NO2,I为一氧化氮,NO2与水反应生成硝酸和一氧化氮,则C为硝酸,则A为硝酸铜,N为红褐色沉淀,为氢氧化铁,则J为铁盐,为硝酸铁,G为铁。
(1) F为Na2O2,电子式为![]() ,过氧化钠与CO2反应的化学方程式为2Na2O2+2CO2=2Na2CO3+O2,用双线桥标出电子转移的方向和数目为
,过氧化钠与CO2反应的化学方程式为2Na2O2+2CO2=2Na2CO3+O2,用双线桥标出电子转移的方向和数目为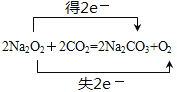 ,故答案为:
,故答案为: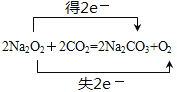 ;
;
(2)反应①为电解硝酸铜溶液,反应的离子方程式为2Cu2++2H2O![]() 2Cu+O2↑+4H+,故答案为:2Cu2++2H2O
2Cu+O2↑+4H+,故答案为:2Cu2++2H2O![]() 2Cu+O2↑+4H+;
2Cu+O2↑+4H+;
(3)硝酸与足量铁反应的化学方程式为3Fe+8HNO3(稀)===3Fe(NO3)2+2NO↑+4H2O,其中,还原剂与氧化剂的物质的量之比为3:2,检验亚铁离子的试剂为K3[Fe(CN)6]溶液,生成蓝色沉淀,故答案为:3Fe+8HNO3(稀)===3Fe(NO3)2+2NO↑+4H2O;3∶2; K3[Fe(CN)6]溶液;
(4)Al能与硝酸铜发生置换反应,反应生成硝酸铝溶液,硝酸铝与Na2CO3发生双水解反应,反应的离子方程式为2Al3++3CO32-+3H2O=2Al(OH)3↓+3CO2↑,故答案为:2Al3++3CO32-+3H2O=2Al(OH)3↓+3CO2↑;
(5)根据质量守恒定律,NO可由氨气催化氧化得到,反应的化学方程式为4NH3+5O2![]() 4NO+6H2O,故答案为:4NH3+5O2
4NO+6H2O,故答案为:4NH3+5O2![]() 4NO+6H2O;
4NO+6H2O;
(6)漂白粉露置于空气中吸收空气中的二氧化碳和水反应生成次氯酸,次氯酸容易分解,失效的化学方程式为Ca(ClO)2+CO2+H2O===CaCO3↓+2HClO、2HClO![]() 2HCl+O2↑,故答案为:Ca(ClO)2+CO2+H2O===CaCO3↓+2HClO、2HClO
2HCl+O2↑,故答案为:Ca(ClO)2+CO2+H2O===CaCO3↓+2HClO、2HClO![]() 2HCl+O2↑。
2HCl+O2↑。


科目:高中化学 来源: 题型:
【题目】已知在298K和101kPa条件下,有如下反应:
反应Ⅰ:C(s) + O2(g) = CO2(g) △ H1=-393.5 kJ·mol-1
反应Ⅱ:2C(s) + O2(g) = 2CO(g) △ H2=-221 kJ·mol-1
反应Ⅲ:N2(g) + O2(g) = 2NO(g) △ H3=+180.5 kJ·mol-1
试回答下列问题:
(1)汽车尾气净化原理为反应Ⅳ:2NO(g) + 2CO(g) ![]() N2(g) + 2CO2(g) △ H=______,该反应能自发进行的条件是_______。(填“高温”、“低温”或“任意温度”)。
N2(g) + 2CO2(g) △ H=______,该反应能自发进行的条件是_______。(填“高温”、“低温”或“任意温度”)。
(2)如果在一定温度下,体积为 2 升的密闭容器中发生化学反应Ⅳ,0~4min各物质物质的量的变化如下表所示:
物质(mol) 时间 | NO | CO | N2 | CO2 |
起始 | 0.40 | 1.0 | ||
2 min 末 | 2.0 | 0.80 | 1.6 | |
4 min 末 | 1.6 |
①求 0~2min 内用 CO 来表示的平均反应速率 v(CO)=________。
②试计算该温度下反应Ⅳ 的化学平衡常数 K=_________。
(3)若一定温度下,在容积可变的密闭容器中,上述反应Ⅳ达到平衡状态,此时容积为3L, c(N2)随时间 t 的变化曲线 x 如图所示。
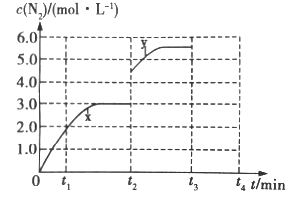
①若在 t2min时改变一个条件,c(N2)随反应时间 t 的变化如曲线 y 所示,则改变的条件是______。
②若在t2min时升高温度,t3min时重新达到平衡,请在图中画出在 t2~t4 内 c(N2)的变化曲线______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在0.1mol/L的CH3COOH溶液中,要促进醋酸电离且氢离子浓度增大,应采取的措施是( )
A.升温 B.降温 C.加入NaOH溶液 D.加入稀HCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】等体积的NaCl、MgCl2、AlCl3三种溶液分别与等体积等物质的量浓度的AgNO3溶液恰好完全反应,则NaCl、MgCl2、AlCl3三种溶液的物质的量浓度之比是
A.1:2:3 B.3:2:1 C.6:3:2 D.1:1:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液含有①NO3-、②HCO3-、③SO32-、④CO32-、⑤SO42-五种阴离子。现向其中加入少量的Na2O2固体后,溶液中离子浓度增大的是(设溶液体积无变化)( )
A. ① B. ④ C. ①④⑤ D. ④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在25 ℃、101 kPa下,1 g甲醇燃烧生成CO2和液态水时放热22.68 kJ,下列热化学方程式正确的是( )
A. CH3OH(l)+![]() O2(g)===CO2(g)+2H2O(l) ΔH=+725.8 kJ/mol
O2(g)===CO2(g)+2H2O(l) ΔH=+725.8 kJ/mol
B. 2CH3OH(l)+3O2(g)===2CO2(g)+4H2O(l) ΔH=-1 452 kJ/mol
C. 2CH3OH(l)+3O2(g)===2CO2(g)+4H2O(l) ΔH=-725.8 kJ/mol
D. 2CH3OH(l)+3O2(g)===2CO2(g)+4H2O(l) ΔH=+1 452 kJmol1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】ClO2是一种消毒杀菌效率高、二次污染小的水处理剂。实验室可通过以下反应制得ClO2:
2KClO3+H2C2O4+H2SO4![]() 2ClO2↑+K2SO4+2CO2↑+2H2O下列说法正确的是
2ClO2↑+K2SO4+2CO2↑+2H2O下列说法正确的是
A.KClO3在反应中失去电子 B.ClO2是氧化剂
C.H2C2O4在反应中被氧化 D.1 mol KClO3参加反应有2 mol电子转移
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】卤族元素及其化合物与社会、生活关系密切。下列有关说法不正确的是( )
A. 加碘食盐中加入的是碘酸钾
B. 常用于杀菌消毒的84消毒液的成分是液氯
C. 可用硝酸银溶液来鉴别纯净水和自来水
D. 变色眼镜和照相器材的生产都要用到溴化银
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com