
 [化学--选修3物质结构与性质]
[化学--选修3物质结构与性质] ,一个BH2=NH2分子中含有5个σ键,所以1mol化合物B中含有σ键的数目5NA,
,一个BH2=NH2分子中含有5个σ键,所以1mol化合物B中含有σ键的数目5NA, ,5NA.
,5NA.


科目:高中化学 来源: 题型:
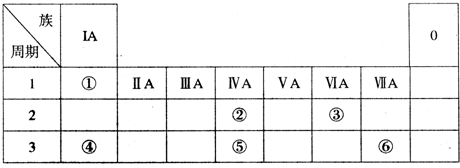

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.1L 1mol/L的AlCl3溶液中Al3+数是0.1NA |
| B、标准状况下,2.24L甲烷分子的电子数是NA |
| C、25℃时,pH=13的1.0L的Ba(OH)2溶液中含有的OH-数是0.2 NA |
| D、0.1L 1mol/L的醋酸溶液中的分子数是0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 (1)依据第2周期元素第一电离能的变化规律,参照右图B、F元素的位置,用小黑点标出C、N、O三种元素的相对位置.
(1)依据第2周期元素第一电离能的变化规律,参照右图B、F元素的位置,用小黑点标出C、N、O三种元素的相对位置.
| ||

 )具有弱酸性,其Ka=1.1×10-10;水杨酸第一级电离形成的离子
)具有弱酸性,其Ka=1.1×10-10;水杨酸第一级电离形成的离子 能形成分子内氢键.据此判断,相同温度下电离平衡常数Ka2(水杨酸)
能形成分子内氢键.据此判断,相同温度下电离平衡常数Ka2(水杨酸)查看答案和解析>>
科目:高中化学 来源: 题型:
 2011年法国化学家Amy Bullen撰文称:在人类文明的历程中,改变世界的事物很多,其中有:铁、硝酸钾、青霉素、氨、乙醇、二氧化碳、聚乙烯、二氧化硅等17个“分子”,改变过人类的世界.
2011年法国化学家Amy Bullen撰文称:在人类文明的历程中,改变世界的事物很多,其中有:铁、硝酸钾、青霉素、氨、乙醇、二氧化碳、聚乙烯、二氧化硅等17个“分子”,改变过人类的世界. )分子中有5n个σ键
)分子中有5n个σ键| 化学键 | Si-Si | O=O | Si-O |
| 键能 (kJ?mol-1) |
a | b | c |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、碳酸盐和盐酸反应生成CO2和水 |
| B、碳酸盐和强酸反应生成CO2和水 |
| C、可溶性碳酸盐和强酸反应生成CO2和水 |
| D、可溶性酸式碳酸盐和强酸反应生成CO2和水 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、硫酸铜溶液与氢氧化钡溶液反应:SO42-+Ba2+→BaSO4↓ |
| B、稀硝酸中加入少量碳酸亚铁:FeCO3+2H+→Fe2++CO2↑+H2O |
| C、硫酸氢铵溶液中滴入几滴氢氧化钠溶液:H++OH-═H2O |
| D、饱和碳酸钠溶液中通入二氧化碳气体:2Na++CO32-+CO2+H2O═2NaHCO3↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com