
| A、由水电离的c(H+)=l×l0-14mol/L的溶液中:Ca2+、K+、Cl-、HCO3- |
| B、能使pH试纸呈红色的溶液:Na+、NH4+、I-、NO3- |
| C、Kw/c(H+)=0.1mol/L的溶液:Na+、K+、SiO32-、NO3- |
| D、FeCl2溶液:K+、Na+、SO42-、AlO2- |


科目:高中化学 来源: 题型:
| A、从开始反应到达平衡,所需时间tA>tB |
| B、平衡时,I2蒸气在混合气体中的体积分数φA>φB |
| C、平衡时,I2蒸气的物质的量浓度[I2]A=[I2]B |
| D、HI的平衡转化率,αA=αB |
查看答案和解析>>
科目:高中化学 来源: 题型:
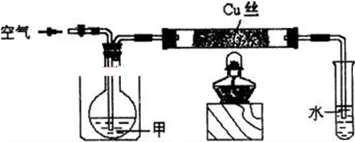
查看答案和解析>>
科目:高中化学 来源: 题型:
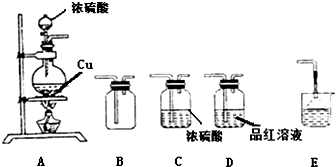
查看答案和解析>>
科目:高中化学 来源: 题型:
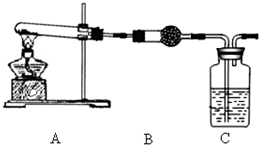
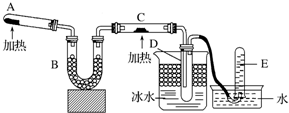 已知氨可以与灼热的氧化铜反应得到氮气和金属铜,用示意图中的装置可以实现该反应.
已知氨可以与灼热的氧化铜反应得到氮气和金属铜,用示意图中的装置可以实现该反应.查看答案和解析>>
科目:高中化学 来源: 题型:
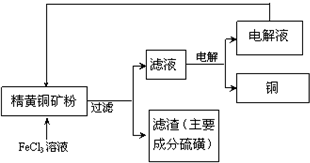 工业上以黄铜矿(主要成分CuFeS2)为原料制备金属铜,有如下两种工艺.
工业上以黄铜矿(主要成分CuFeS2)为原料制备金属铜,有如下两种工艺.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
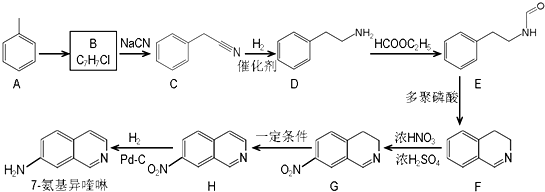
 .请回答下列问题:
.请回答下列问题: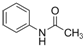 ),请设计合成路线(无机试剂及溶剂任选).
),请设计合成路线(无机试剂及溶剂任选).| O2 |
| 催化剂/△ |
| 乙醇 |
| 浓硫酸/△ |
查看答案和解析>>
科目:高中化学 来源: 题型:
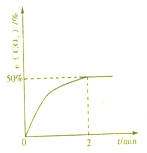 处理含CO、SO2烟道气污染的一种方法,是将其在催化剂作用下转化为单质S(g).发生反应为:2CO(g)+SO2(g)?S(g)+2CO2(g)
处理含CO、SO2烟道气污染的一种方法,是将其在催化剂作用下转化为单质S(g).发生反应为:2CO(g)+SO2(g)?S(g)+2CO2(g)| 1 |
| 2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com