
分析 (1)根据酸碱盐在水中会电离出离子,金属、水、沉淀、气体不能电离进行分析;
(2)根据氧化还原反应中氧化剂、还原剂,以及氧化反应、还原反应的判断方法进行分析;
(3)根据公式c=$\frac{n}{V}$来进行计算.
解答 解:(1)铜、一氧化氮、水在水中不会电离,硝酸在水中电离出氢离子和硝酸根离子,依据离子电荷守恒进行书写,故答案为:3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O;
(2)在氧化还原反应中,化合价降低的是氧化剂,发生的是还原反应,生成的是还原产物,化合价升高的是还原剂,发生的是氧化反应,生成的是氧化产物,8个硝酸分子中有6个硝酸分子没有参加还原反应,则被还原的硝酸的物质的量是参加反应的硝酸物质的量的$\frac{1}{4}$,若有19.2g即0.3mol铜被氧化,参加反应的硝酸物质的量是0.8mol,则被还原的硝酸的物质的量为0.2mol,故答案为:0.2mol;
(3)若有19.2g即0.3mol铜被氧化,则产生Cu(NO3)2的物质的量是0.3mol,若反应后溶液体积为1L,则Cu(NO3)2溶液的物质的量浓度为c=$\frac{n}{V}$=0.3mol/L,故答案为:0.3mol/L.
点评 在解此类题时,首先分析题中考查的问题,然后结合学过的知识进行分析解答,注意学会用化合价的变化观点分析氧化还原反应.


 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案科目:高中化学 来源: 题型:解答题
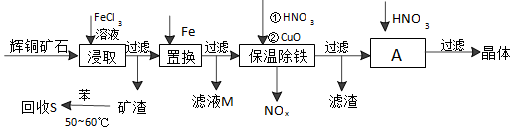
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
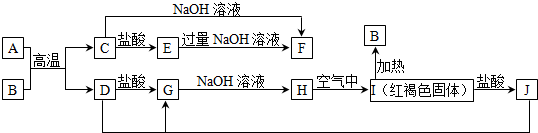
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.15NA | B. | 0.6NA | C. | 1.2NA | D. | 2.4NA |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
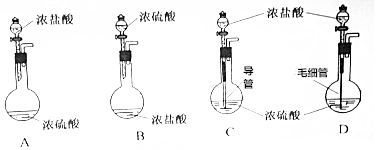
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
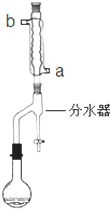 在苹果、香蕉等水果的果香中存在着乙酸正丁酯.某化学课外兴趣小组欲以乙酸和正丁醇为原料合成乙酸正丁酯.实验步骤如下:
在苹果、香蕉等水果的果香中存在着乙酸正丁酯.某化学课外兴趣小组欲以乙酸和正丁醇为原料合成乙酸正丁酯.实验步骤如下:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
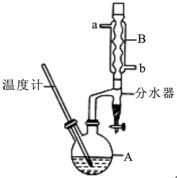 正丁醚常用作有机反应的溶剂.实验室制备正丁醚的反应和主要实验装置如下:2CH3CH2CH2CH2OH$→_{△}^{浓硫酸}$CH3CH2CH2CH2)2O,反应物和产物的相关数据如下表:
正丁醚常用作有机反应的溶剂.实验室制备正丁醚的反应和主要实验装置如下:2CH3CH2CH2CH2OH$→_{△}^{浓硫酸}$CH3CH2CH2CH2)2O,反应物和产物的相关数据如下表:| 相对分子质量 | 沸点/℃ | 密度/(g/cm3) | 水中的溶解性 | |
| 正丁醇 | 74 | 117.2 | 0.8109 | 微溶 |
| 正丁醚 | 130 | 142.0 | 0.7704 | 几乎不溶 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Y的能量一定高于N | |
| B. | X、Y的能量总和高于M、N的能量总和 | |
| C. | 因为该反应为放热反应,故不必加热就可发生 | |
| D. | 断裂X、Y的化学键所吸收的能量高于形成M、N的化学键所放出的能量 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com