
【题目】已知A是一种常见金属,部分反应物或生成物已略去。试根据图中转化关系,回答下列问题。
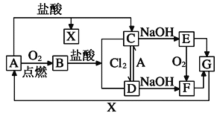
(1)B的俗名为____。
(2)保存C溶液时需加入少量A的原因是____,A与水蒸气反应的化学方程式为____,该反应类型属于____(填基本反应类型)
(3)E生成F可观察到的现象____,化学方程式为____。
(4)写出B→C化学方程式为____,C→D的离子方程式为____。
【答案】磁性氧化铁 防止Fe2+被O2氧化 3Fe+4H2O ![]() Fe3O4+4H2 置换反应 白色沉淀迅速变成灰绿色,最终变成红褐色 4Fe(OH)2 + 2H2O+O2 = 4Fe(OH)3 Fe3O4 + 8HCl=FeCl2 + 2FeCl3 + 4H2O 2Fe2+ + Cl2=2Fe3+ + 2Cl-
Fe3O4+4H2 置换反应 白色沉淀迅速变成灰绿色,最终变成红褐色 4Fe(OH)2 + 2H2O+O2 = 4Fe(OH)3 Fe3O4 + 8HCl=FeCl2 + 2FeCl3 + 4H2O 2Fe2+ + Cl2=2Fe3+ + 2Cl-
【解析】
A是一种常见金属,燃烧后生成的氧化物B与盐酸反应能够生成两种氯化物,符合条件的常见金属是铁,所以由图中转化关系得,A为Fe,B为Fe3O4,C为FeCl2,D为FeCl3,X为H2,E为Fe(OH)2,F为Fe(OH)3,G为Fe2O3。
(1)由分析可知B为Fe3O4,俗名为磁性氧化铁,故答案为:磁性氧化铁;
(2)因为Fe2+极易被O2氧化,所以保存FeCl2溶液时需加入少量Fe,Fe与水蒸气反应的化学方程式为3Fe+4H2O ![]() Fe3O4+4H2,该反应属于置换反应,故答案为:防止Fe2+被O2氧化;3Fe+4H2O
Fe3O4+4H2,该反应属于置换反应,故答案为:防止Fe2+被O2氧化;3Fe+4H2O ![]() Fe3O4+4H2;置换反应;
Fe3O4+4H2;置换反应;
(3)Fe(OH)2沉淀在空气中被氧化生成Fe(OH)3,可观察到的现象是白色沉淀迅速变成灰绿色,最终变成红褐色,化学方程式为:4Fe(OH)2 + 2H2O+O2 = 4Fe(OH)3;故答案为:白色沉淀迅速变成灰绿色,最终变成红褐色;4Fe(OH)2 + 2H2O+O2 = 4Fe(OH)3;
(4)Fe3O4与盐酸反应得化学方程式为Fe3O4 + 8HCl=FeCl2 + 2FeCl3 + 4H2O,FeCl2与Cl2反应得离子方程式为2Fe2++Cl2=2Fe3++2Cl-,故答案为:Fe3O4 + 8HCl=FeCl2 + 2FeCl3 + 4H2O;2Fe2+ + Cl2=2Fe3+ + 2Cl-。


 黄冈小状元解决问题天天练系列答案
黄冈小状元解决问题天天练系列答案 三点一测快乐周计划系列答案
三点一测快乐周计划系列答案科目:高中化学 来源: 题型:
【题目】实验室欲用NaOH固体配制1.0 mol/L的NaOH溶液480 mL:
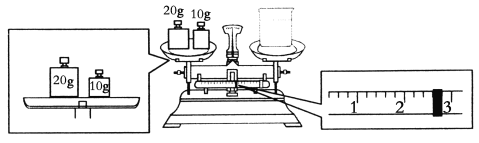
(1)配制时,必须使用的玻璃仪器有胶头滴管、烧杯、玻璃棒、________。
(2)要完成本实验该同学应称出NaOH________g。
(3)某同学欲称量NaOH的质量,他先用托盘天平称量烧杯的质量,天平平衡后的状态如图,烧杯的实际质量为________g。
(4)使用容量瓶前必须进行的一步操作是________。
(5)在配制过程中,其他操作都是正确的,下列操作会引起误差偏高的是________。
①没有洗涤烧杯和玻璃棒
②转移溶液时不慎有少量洒到容量瓶外面
③容量瓶不干燥,含有少量蒸馏水
④定容时俯视刻度线
⑤未冷却到室温就将溶液转移到容量瓶并定容
⑥定容后塞上瓶塞反复摇匀,静置后,液面低于刻度线,再加水至刻度线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室可用KMnO4和浓盐酸反应制取氯气。
KMnO4+HCl(浓)=KCl+MnCl2+Cl2↑+H2O(未配平)
(1)配平化学方程式,并用单线桥标出电子转移的方向和数目。
(2)将上述配平的化学方程式改写为离子方程式 。
(3)浓盐酸在反应中显示出来的性质是________________
①只有还原性 ②还原性和酸性
③只有氧化性 ④氧化性和酸性
(4)若产生0.5molCl2,则被氧化的HCl mol,转移的电子的数目约为___________。
(5)一定条件下,KMnO4还可以氧化其他还原性物质。
MnO4-+C2O42-+ = Mn2+ +CO2↑+
完成上述离子方程式,此反应中,发生氧化反应的物质是 ;若转移1mol电子,生成标准状况下CO2 L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苄叉二氯(![]() ,沸点为206℃)是合成苯甲醛的中间体,实验室合成苄叉二氯的装置如图1所示。
,沸点为206℃)是合成苯甲醛的中间体,实验室合成苄叉二氯的装置如图1所示。
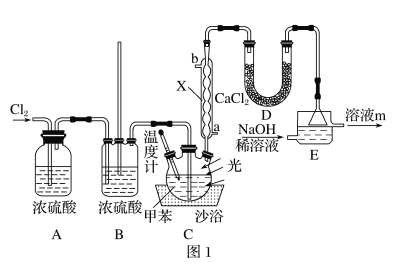
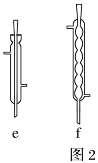
回答下列问题:
(1)实验室常用二氧化锰与浓盐酸反应制取氯气,反应的离子方程式为____。
(2)图1中装置A的作用是___,装置B的作用是___,装置D的作用是____。
(3)仪器X的名称为___,冷凝水从__(填“a”或“b”)口进入;装置C中甲苯与Cl2反应生成苄叉二氯的化学方程式为__。
(4)最后蒸馏收集204℃~208℃的馏分,蒸馏时用的冷凝管可选用图2中的___(填字母)。
(5)若实验前甲苯的质量为46g,最后苄叉二氯的质量也是46g,则该实验的产率为:____(保留3位有效数字)。
(6)设计实验证明溶液m中含有ClO-:____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有机物说法不正确的是( )
A. 对甲基苯乙烯中最多有17个原子共面
B. 萘环(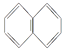 )上的一个H原子被-C4H9取代后的产物共有8种
)上的一个H原子被-C4H9取代后的产物共有8种
C. BrCH2CHBrCH2Br的名称为三溴丙烷
D. 立方烷(![]() )一氯代物1种、二氯代物有3种、三氯代物也有3种
)一氯代物1种、二氯代物有3种、三氯代物也有3种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物F(盐酸地拉普利)是一种治疗高血压的药物,其合成路线流程图如图:
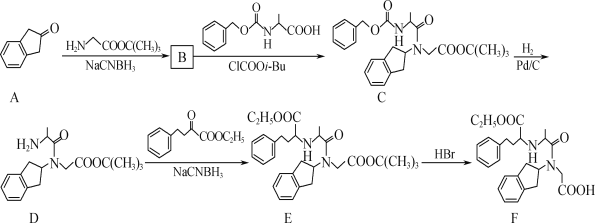
(1)D中的官能团有酰胺键、__和__(填名称)。
(2)E→F的反应类型为__。
(3)B的分子式为C15H21O2N,写出B的结构简式:__。
(4)A的一种同分异构体M同时满足下列条件,写出M的结构简式:___。
①M是一种芳香族化合物,能与NaOH溶液发生反应;
②M分子中有4种不同化学环境的氢。
(5)已知:R—X![]() R—CN
R—CN![]() R—CH2NH2。
R—CH2NH2。
写出以![]() 为原料制备
为原料制备![]() 的合成路线流程图(无机试剂任选,合成路线流程图示例见本题题干)___。
的合成路线流程图(无机试剂任选,合成路线流程图示例见本题题干)___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Na2S2O35H2O俗称“海波”,是重要的化工原料,常用作脱氯剂、定影剂和还原剂。
(1)Na2S2O3还原性较强,在碱性溶液中易被Cl2氧化成SO42﹣,常用作脱氯剂,该反应的离子方程式是_____。
(2)测定海波在产品中的质量分数:依据反应2S2O32﹣+I2=S4O62﹣+2I﹣,可用I2的标准溶液测定产品的纯度。称取5.500g产品,配制成100mL溶液。取10.00mL该溶液,以淀粉溶液为指示剂,用浓度为0.05000molL﹣1I2的标准溶液进行滴定,相关数据记录如表所示。
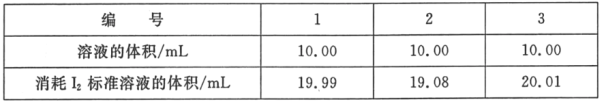
①判断滴定终点的现象是_____。
②若滴定时振荡不充分,刚看到溶液局部变色就停止滴定,则测量的Na2S2O35H2O的质量分数会_____(填“偏高”、“偏低”或“不变”)
③计算海波在产品中的质量分数(写出计算过程)。_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】成语是中国传统文化的瑰宝。铜墙铁壁、铜心铁胆、金戈铁马、百炼成钢等成语向人传递正能量。工业上,冶炼铁的有关热化学方程式如下:①C(s)+O2(g)=CO2(g) △H1=akJ·mol-1;②CO2(g)+C(s)=2CO(g) △H2=bkJ·mol-1;③Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g) △H3=ckJ·mol-1;④2Fe2O3(s)+3C(s)=4Fe(s)+3CO2(g ) △H4=dkJ·mol-1(上述热化学方程式中,a,b,c,d均不等于0)下列说法正确的是
A. b<aB. CO(g)+ 1/2O2(g)= CO2(g) △H<akJ·mol-1
C. d=3c+2bD. C(s)+ 1/2O2(g)=CO (g) △H=(a+b)/2kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,向20. 00 mL 0.1 mol/L H2X溶液中滴入0.1 mo1/L NaOH溶液,溶液中由水电离出的c水(OH-) 的负对数[一lgc水(OH-)]即pOH水-与所加NaOH溶液体积的关系如图所示。下列说法中正确的是
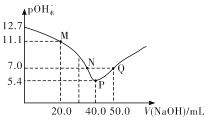
A.水的电离程度:M>PB.图中P点至Q点对应溶液中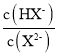 逐渐增大
逐渐增大
C.N点和Q点溶液的pH相同D.P点溶液中![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com