
【化学——选修3:物质结构与性质】(15分)
目前半导体生产展开了一场“铜芯片”革命——在硅芯片上用铜代替铝布线,古老的金属铜在现代科技应用上取得了突破,用黄铜矿(主要成分为CuFeS2)生产粗铜,其反应原理如下:

(1)基态铜原子的外围电子层排布为__________________,硫、氧元素相比,第一电离能较大的元素是________(填元素符号)。
(2)反应①、②中均生成有相同的气体分子,该分子的中心原子杂化类型是________,其立体结构是______________。
(3)某学生用硫酸铜溶液与氨水做了一组实验:CuSO4溶液 蓝色沉淀
蓝色沉淀 沉淀溶解,得到深蓝色透明溶液。写出蓝色沉淀溶于氨水的离子方程式_______________________;深蓝色透明溶液中的阳离子内存在的化学键类型有 。
沉淀溶解,得到深蓝色透明溶液。写出蓝色沉淀溶于氨水的离子方程式_______________________;深蓝色透明溶液中的阳离子内存在的化学键类型有 。
(4)铜是第四周期最重要的过渡元素之一,其单质及化合物具有广泛用途,铜晶体中铜原子堆积模型为_____________;铜的某种氧化物晶胞结构如图所示,若该晶体的密度为d g/cm3,阿伏加德罗常数的值为NA,则该晶胞中铜原子与氧原子之间的距离为________cm。((用含d和NA的式子表示)。

(除标记外每空2分,共15分)
(1) 3d104s1 O (2)sp2 V形
(3) Cu(OH)2+4NH3·H2O=[Cu(NH3)4]2+ +2OH- +4H2O 共价键、配位键(各1分)
(4) 面心立方最密堆积(1分) 
【解析】
试题分析:(1)Cu原子的外围电子数是11个,根据电子的填充原则,所以外围电子排布式为3d104s1;S与O元素是同主族元素,同主族元素的第一电离能随核电荷数的增多而减小,所以O元素的第一电离能较大;
(2)反应①、②中均生成有相同的气体分子SO2,S原子的价层电子对数是2+1/2(6-4)=3,所以是sp2杂化,有一对孤对电子,所以空间构型是V型;
(3)硫酸铜与氨水反应先生成氢氧化铜沉淀,再加入氨水沉淀溶解,是因为氢氧化铜与一水合氨反应生成氢氧化四氨合铜,溶液为深蓝色,氢氧化铜与一水合氨反应的离子方程式是Cu(OH)2+4NH3·H2O=[Cu(NH3)4]2+ +2OH- +4H2O;深蓝色溶液中的阳离子是四氨合铜络离子,NH3分子中存在共价键,NH3与铜离子之间形成配位键;
(4)Cu晶体中Cu原子的堆积方式是面心立方最密堆积,8个顶点和6个面心各有1个Cu原子;该铜的氧化物的晶胞内4个Cu原子位于体内,O原子的个数是8×1/8+1=2,Cu原子位于顶点和体心的O原子的中点,设晶胞的边长为x,则晶胞的密度可表示为d g/cm3=(4×64+2×16)/NA/x3=288/NAx3,铜原子与氧原子之间的距离为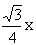 =
=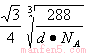 。
。
考点:考查物质结构与性质的应用,晶胞的计算
考点分析: 考点1:物质的结构与性质 考点2:晶体结构与性质 考点3:元素周期律与元素周期表 试题属性

 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案 小学教材完全解读系列答案
小学教材完全解读系列答案科目:高中化学 来源:2014-2015山东省枣庄市高一上学期期末化学试卷(解析版) 题型:选择题
以下关于化学实验中“先”与“后”的说法正确的是
①加热试管时,先均匀加热,后局部加热
②做H2还原CuO实验时,先通H2,后加热CuO,反应完毕后,先撤酒精灯待试管冷却,后停止通H2
③制取气体时,先检查装置气密性,后装药品
④点燃可燃性气体如H2、CO等时,先检验气体纯度,后点燃
⑤制取蒸馏水时,先通冷却水,后加热烧瓶
⑥进行分液操作时,先从上口倒出上层液体,后从通过下端活塞放出下层液体
A.①②③④ B.①②③④⑤ C.①②③④⑥ D.全部
查看答案和解析>>
科目:高中化学 来源:2014-2015学年浙江省六校高三3月联考理综化学试卷(解析版) 题型:选择题
根据下表提供的数据,下列判断正确的是

A.等物质的量的Na2CO3和CH3COOH两种溶液混合,一定有:
B.常温下,已知酸H2A存在如下平衡: ;
; ,则NaHA溶液中水的电离程度一定大于纯水中水的电离程度
,则NaHA溶液中水的电离程度一定大于纯水中水的电离程度
C.相同浓度的CH3COONa和NaClO混合溶液中各离子浓度大小关系是:c(Na+)> c(ClO-)> c(CH3COO-)> c(OH-)>c(H+)
D.常温下,在0.1mol/LCH3COOH溶液中滴加0.1mol/LNaOH的溶液发生反应,当c(CH3COOH):c(CH3COO-)=5:9时,此时溶液pH=5
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东省日照市高三3月模拟考试理综化学试卷(解析版) 题型:推断题
(12分)【化学一有机化学基础】
聚乙酸乙烯酯又名聚醋酸乙烯酯,主要用作涂料、胶黏剂、纸张、口香糖基料和织物整理剂,其合成路线如下,其中物质J与氯化铁溶液能发生显色反应。

已知:①当羟基与双键碳原相连时,易发生如下转化RCH=CHOH→RCH2CHO;
②—ONa连在烃基上不易被氧化。
请回答下列问题:
(1)写出G的结构简式__________;F与H中具有相同官能团的名称___________。
(2)J在一定条件下能生成高聚物K,K的结构简式是___________________。
(3)同时符合下列要求的A的同分异构体有_____________种。
①含有苯环
②苯环上有2个取代基
③能发生银镜反应和水解反应
(4)写出B→C+D反应的化学方程式:______________________________________。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东省日照市高三3月模拟考试理综化学试卷(解析版) 题型:选择题
镁铝合金5.4g溶于过量的热浓硝酸中,反应产生11.2 LNO2(标准状况),若在反应后溶液中加入过量的氢氧化钠溶液,则生成沉淀质量为
A.4.5g B.6 g C.8.7g D.13.9g
查看答案和解析>>
科目:高中化学 来源:2014-2015学年湖南省怀化市高三第一次模拟考试理综化学试卷(解析版) 题型:选择题
下列叙述正确的是
A.常温下,10 mL 0.02 mol·L-1 HCl溶液与10 mL 0.02 mol·L-1 Ba(OH)2溶液充分混合,若混合后溶液的体积为20 mL,则溶液的pH=12
B.常温下,向AgCl的饱和溶液中加入NaCl固体,有固体析出,且AgCl的Ksp变小
C.在0.1 mol·L-1 CH3COONa溶液中,c(OH-)>c(CH3COOH)+c(H+)
D.常温下pH=4的NaHC2O4溶液中:c(H2C2O4)>c(C2O42-)
查看答案和解析>>
科目:高中化学 来源:2014-2015学年福建省泉州五校高三上学期摸底联考化学试卷(解析版) 题型:实验题
(17分)实验室中利用下图所示装置制备纳米碳酸钙(1纳米=1×10-9m)(部分夹持装置已略去),向饱和CaCl2溶液中通入NH3和CO2可制得纳米碳酸钙

供选择的药品:①石灰石 ②氯化铵 ③氢氧化钙 ④饱和氯化钙溶液 ⑤浓硫酸
⑥6 mol·L-1盐酸 ⑦饱和食盐水 ⑧饱和NaHCO3溶液
(1)装置A中,仪器a的名称是 ,仪器b中应盛放的固体为 。(填药品序号)。装置B 中盛放的溶液是 (填药品序号)。装置D的试管中发生反应的化学方程式为 。
(2)如何判断所得碳酸钙颗粒是否为纳米级。 。
(3)通入适量气体后,C装置中物质恰好完全反应,过滤,所得滤液显 (填“酸”、“碱”、“中”之一)性。
(4)装置C中, 右边的导管并未插入液面,原因是
(5)上述装置存在一处缺陷,该缺陷为 。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年福建省泉州五校高三上学期摸底联考化学试卷(解析版) 题型:选择题
在一无色溶液中检验出有Ba2+、Ag+,同时又测得其酸性很强。某学生还要鉴定此溶液中是否大量存在:①Cu2+ ②Fe3+ ③ Cl-④ NO3-⑤S2- ⑥CO32- ⑦ NH4+ ⑧Mg2+⑨Al3+ ⑩AlO2-离子。其实,这些离子中有一部分不必再鉴定就能加以否定,你认为不必鉴定的离子组是
A.③⑤⑥⑦⑩ B.①②⑤⑥⑧⑨ C.③④⑦⑧⑨ D.①②③⑤⑥⑩
查看答案和解析>>
科目:高中化学 来源:2014-2015学年北京市石景山区高三上学期期末考试化学试卷(解析版) 题型:选择题
设NA表示阿伏加德罗常数的值,下列说法正确的是
A.1mol OH含有的电子数目为9NA
B.1mol Cl2和氢氧化钠完全反应,转移的电子数目为NA
C.室温下,1L pH=1的H2SO4溶液中,由水电离出的H+数目为0.1NA
D.1mol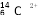 所含中子数目为6NA
所含中子数目为6NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com