
| 阳离子 | K+ Na+ Cu2+ Al3+ |
| 阴离子 | SO42- HCO3-NO3- OH- |
分析 ①将它们溶于水后,D为蓝色溶液,其他均为无色溶液,则D中含有Cu2+离子;
②将E溶液滴入到C溶液中,出现白色沉淀,继续滴加沉淀溶解,则C中含有Al3+离子,E中含有OH-离子;
③进行焰色反应实验,只有B、C为紫色,则B、C含有K+离子,结合离子共存,所以E是NaOH;
④在各溶液中加入Ba(NO3)2溶液,再加入过量稀硝酸,A中放出无色气体,则A中含有HCO3-离子,C、D中产生白色沉淀,则C、D中含有SO42-离子,所以D是CuSO4,C是KAl(SO4)2,A是NaHCO3;
⑤将B、D两溶液混合,未见沉淀或气体生成,则B是KNO3.
解答 解:①将它们溶于水后,D为蓝色溶液,其他均为无色溶液,则D中含有Cu2+离子;
②将E溶液滴入到C溶液中,出现白色沉淀,继续滴加沉淀溶解,则C中含有Al3+离子,E中含有OH-离子;
③进行焰色反应实验,只有B、C为紫色,则B、C含有K+离子,结合离子共存,所以E是NaOH;
④在各溶液中加入Ba(NO3)2溶液,再加入过量稀硝酸,A中放出无色气体,则A中含有HCO3-离子,C、D中产生白色沉淀,则C、D中含有SO42-离子,所以D是CuSO4,C是KAl(SO4)2,A是NaHCO3;
⑤将B、D两溶液混合,未见沉淀或气体生成,则B是KNO3.
(1)由上述分析可知,B为KNO3,D为CuSO4,
故答案为:KNO3;CuSO4;
(2)在A是NaHCO3溶液中加入少量澄清石灰水,发生反应生成碳酸钙沉淀,观察到的现象为产生白色沉淀,
故答案为:产生白色沉淀;
(3)A是NaHCO3,E是NaOH,1mol A的溶液与含1mol E的溶液反应生成碳酸钠和水,蒸干过程中碳酸钠水解得到碳酸氢钠与氢氧化钠,最终二者又反应得到Na2CO3,反应的离子方程式为:HCO3-+OH-=H2O+CO32-,
故答案为:Na2CO3 ,HCO3-+OH-=H2O+CO32-;
(4)C中含有铝离子,铝离子易水解生成氢氧化铝胶体,胶体具有吸附性,能吸附水 中的悬浮物而净水,水解反应方程式为:Al3++3H2O?Al(OH)3(胶体)+3H+,
故答案为:Al3++3H2O=Al(OH)3(胶体)+3H+.
点评 本题考查无机物推断,属于未知物的检验推断,涉及离子共存、离子反应等,关键明确离子之间发生的反应现象,有利于培养学生的逻辑思维推理能力和,难度中等.


科目:高中化学 来源: 题型:选择题
 的有机物,下列关于它的说法不正确的是( )
的有机物,下列关于它的说法不正确的是( )| A. | 分子式为C10H16 | B. | 其一氯代物有8种 | ||
| C. | 能与溴水发生加成反应 | D. | 难溶于水,且密度比水大 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,其空间构型是直线形,由此可知它是非极性(填“极性”或“非极性”)分子.
,其空间构型是直线形,由此可知它是非极性(填“极性”或“非极性”)分子.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
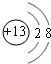 E在周期表中的位置第三周期第VIIA族
E在周期表中的位置第三周期第VIIA族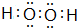
| 选项 | a | b | c | d |
| X | 温度 | 加入氢气 | 加入丙 | 温度 |
| Y | n(丙) | 丙的转化率 | n(生成物) | n(H2) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
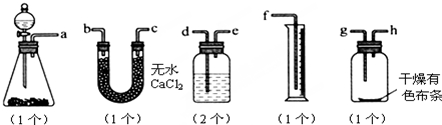
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若纯碱中混有K2CO3,盐酸用量将偏大;气体产量将偏大 | |
| B. | 若纯碱中混有NaHCO3,盐酸用量将偏大;气体产量将偏大 | |
| C. | 若纯碱中混有KHCO3,盐酸用量将偏小;气体产量将偏大 | |
| D. | 若纯碱中混有Na2SO3,盐酸用量将偏大;气体产量将偏小 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com