
| A、增大 | B、减小 |
| C、不变 | D、无法判断 |
 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案科目:高中化学 来源: 题型:
| A、H+、Na+、HCO3-、Cl- |
| B、Cu2+、Na+、Cl-、SO42- |
| C、Mg2+、K+、SO42-、OH- |
| D、Ag+、Al3+、NO3-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:
 某学生利用如图装置探究氯气与氨气之间的反应.其中A、F分别为氨气和氯气的发生装置,C为纯净干燥的氯气与氨气反应的装置.
某学生利用如图装置探究氯气与氨气之间的反应.其中A、F分别为氨气和氯气的发生装置,C为纯净干燥的氯气与氨气反应的装置.查看答案和解析>>
科目:高中化学 来源: 题型:
 (I)如图是某学校林老师制备NH3并进行性质实验时的改进装置.按图1把仪器安装好,称取2g固体氯化铵装入试管底部,再称取2g氢氧化钠覆盖在氯化铵上方;立即用带有滴管的塞子塞紧(滴管预先吸入约2mL浓氨水);烧杯内盛滴有酚酞试液的水:把浓氨水滴入试管里,可立即观察到试管内发生剧烈反应,有大量气泡.
(I)如图是某学校林老师制备NH3并进行性质实验时的改进装置.按图1把仪器安装好,称取2g固体氯化铵装入试管底部,再称取2g氢氧化钠覆盖在氯化铵上方;立即用带有滴管的塞子塞紧(滴管预先吸入约2mL浓氨水);烧杯内盛滴有酚酞试液的水:把浓氨水滴入试管里,可立即观察到试管内发生剧烈反应,有大量气泡.查看答案和解析>>
科目:高中化学 来源: 题型:
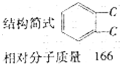 实验室中某试剂瓶的标签严重破损,只能隐约看到如图所示部分:
实验室中某试剂瓶的标签严重破损,只能隐约看到如图所示部分: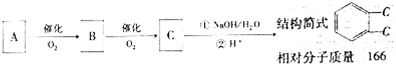
查看答案和解析>>
科目:高中化学 来源: 题型:
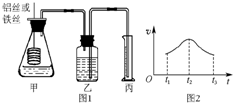 某研究小组拟用定量的方法测量Al和Fe分别与酸反应的快慢,设计了如下图1所示的装置.
某研究小组拟用定量的方法测量Al和Fe分别与酸反应的快慢,设计了如下图1所示的装置.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、等浓度的NaClO、NaHCO3混合溶液中:c(HClO)+c(ClO-)=c(HCO3-)+c(H2CO3)+c(CO32-) |
| B、新制氯水中:c(Cl-)>c(H+)>c(OH-)>c(ClO-) |
| C、室温下,向0.01mol/LNH4HSO4 溶液中滴加NaOH溶液至中性:c(Na+)>c(SO42->c(NH4+)>c(OH-)=c(H+) |
| D、物质的量浓度均为0.1mol/L的NaA和NaB混合溶液中,离子浓度可能的关系为:c(Na+)>c(OH-)>c(HA)>c(HB) |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、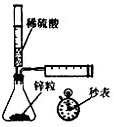 测定一定时间内生成H2的反应速率 |
B、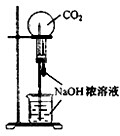 用CO2做喷泉实验 |
C、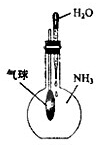 验证NH3易溶于水 |
D、 比较Na2CO3与NaHCO3的热稳定性 |
查看答案和解析>>
科目:高中化学 来源: 题型:
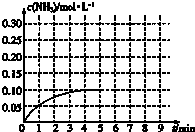 在一容积为2L的密闭容器内加入0.2mol的N2和0.6mol的H2,在一定条件下发生如下反应:N2(g)+3H2(g)?2NH3(g)△H<0,反应中NH3的物质的量浓度的变化情况如图:
在一容积为2L的密闭容器内加入0.2mol的N2和0.6mol的H2,在一定条件下发生如下反应:N2(g)+3H2(g)?2NH3(g)△H<0,反应中NH3的物质的量浓度的变化情况如图:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com