
【题目】下列各表述与示意图一致的是( )
A.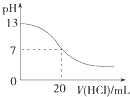 图表示25℃时,用0.1 molL﹣1盐酸滴定20 mL 0.1 molL﹣1 NaOH溶液,溶液的pH随加入酸体积的变化
图表示25℃时,用0.1 molL﹣1盐酸滴定20 mL 0.1 molL﹣1 NaOH溶液,溶液的pH随加入酸体积的变化
B.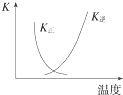 图中曲线表示反应2SO2(g)+O2(g)2SO3(g)△H<0正、逆反应的平衡常数K随温度的变化
图中曲线表示反应2SO2(g)+O2(g)2SO3(g)△H<0正、逆反应的平衡常数K随温度的变化
C.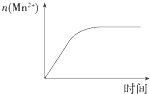 图表示10 mL 0.01 molL﹣1 KMnO4酸性溶液与过量的0.1 molL﹣1 H2C2O4溶液混合时,n(Mn2+)随时间的变化
图表示10 mL 0.01 molL﹣1 KMnO4酸性溶液与过量的0.1 molL﹣1 H2C2O4溶液混合时,n(Mn2+)随时间的变化
D.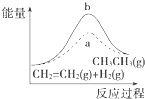 图中a、b曲线分别表示反应CH2═CH2(g)+H2(g)﹣→CH3CH3(g)△H<0使用和未使用催化剂时,反应过程中的能量变化
图中a、b曲线分别表示反应CH2═CH2(g)+H2(g)﹣→CH3CH3(g)△H<0使用和未使用催化剂时,反应过程中的能量变化
【答案】B
【解析】解:A.用0.1 molL﹣1盐酸滴定20 mL 0.1 molL﹣1NaOH溶液的pH随加入盐酸体积的变化,pH会突变,故A错误; B.2SO2(g)+O2(g)2SO3(g)△H<0,升高温度平衡向吸热方向移动,即向逆方向移动,则逆方向是平衡常数增大,正方向的平衡常数减小,图象符合,故B正确;
C.反应中生成的Mn2+对该反应有催化作用,反应过程中溶液中锰离子浓度逐渐增大,所以反应速率先慢后快,图象不符合,故C错误;
D.CH2═CH2(g)+H2(g)﹣→CH3CH3(g)△H<0,属于放热反应,放热反应中反应物的总能量大于生成物的总能量,图象不符合,故D错误.
故选B.
A.酸碱完全中和的时候pH会突变;
B.升高温度平衡向吸热方向移动;
C.反应中生成的Mn2+对该反应有催化作用;
D.放热反应中反应物的总能量大于生成物的总能量.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】按要求写出相关的方程式:
(1)写出电解饱和食盐水的化学方程式
(2)氯化铵溶液呈现酸碱性的离子方程式
(3)乙醇和氧气以KOH为电解质的溶液形成的燃料电池的负极电极反应式
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】辉铜矿(主要成分是Cu2S)是冶炼铜的主要原料,辉铜矿样品的纯度可以用酸性高锰酸钾溶液滴定来测定,该反应可表示为Cu2S+ ![]() +H+→Cu2++
+H+→Cu2++ ![]() +Mn2++H2O(未配平)。下列说法中不正确的是( )
+Mn2++H2O(未配平)。下列说法中不正确的是( )
A.Cu2S为还原剂被氧化, ![]() 为氧化剂被还原
为氧化剂被还原
B.氧化剂和还原剂物质的量之比为2∶1
C.反应中每消耗1 mol Cu2S,转移8 mol电子
D.滴定时可以不加其他的指示剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 直径介于1 nm ~ 100 nm 之间的微粒称为胶体
B. 胶体粒子很小,可以透过半透膜
C. 利用丁达尔效应可以区别溶液和胶体
D. 向FeCl3溶液中加入NaOH溶液可制得Fe(OH)3胶体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】聚维酮碘的水溶液是一种常见的碘伏类缓释消毒剂,聚维酮通过氢键与HI3形成聚维酮碘,其结构表示如下 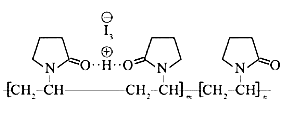 (图中虚线表示氢键)
(图中虚线表示氢键)
下列说法不正确的是( )
A.聚维酮的单体是 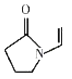
B.聚维酮分子由(m+n)个单体聚合而成
C.聚维酮碘是一种水溶性物质
D.聚维酮在一定条件下能发生水解反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A.在25℃时,将amol?L﹣1的氨水与0.01 mol?L﹣1的盐酸等体积混合,反应完全时溶液中c(NH4+)=c(Cl﹣),用含a的代数式表示NH3?H2O的电离常数:Kb= ![]()
B.在一定条件下,将X和Y两种物质按不同的比例放入密闭容器中反应生成Z,平衡后测得X、Y的转化率与起始时两物质的物质的量之比n(X)/n(Y>的关系如图所示,则x与Y的反应方程式可表示为:X+3Y?nZ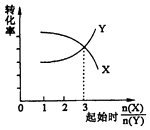
C.某同学在实验室进行了如图所示的实验,则Y中反应的离子方程式为:3CaCO3+2Fe3++3H2O═2Fe(OH)3+3CO2↑+3Ca2+
D.将10mL 1 mol?L﹣1Na2CO3溶液逐滴滴加到10mL1mol?L﹣1盐酸中,滴加结束后生成的溶液中有:C(Na+)>c(Cl﹣)>c(CO32﹣)>c(HCO3﹣)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫代硫酸钠溶液与稀硫酸反应的化学方程式为:Na2S2O3+H2SO4═Na2SO4+SO2↑+S↓+H2O,下列各组实验中最先出现浑浊的是( )
实验 | 反应温度/℃ | Na2S2O3溶液 | 稀H2S4 | H2O | ||
V/mL | c(molL﹣1) | V/mL | c(molL﹣1) | V/mL | ||
A | 25 | 5 | 0.1 | 10 | 0.1 | 5 |
B | 25 | 5 | 0.2 | 5 | 0.2 | 10 |
C | 35 | 5 | 0.1 | 10 | 0.1 | 5 |
D | 35 | 5 | 0.2 | 5 | 0.2 | 10 |
A.A
B.B
C.C
D.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:I2在水中溶解度很小,在KI溶液中溶解度显著增大. I2在KI溶液中存在下列平衡:I2(aq)+I﹣(aq)I3﹣(aq).测得不同温度下该反应的平衡常数如图所示,下列说法正确的是( ) 
A.反应I2(aq)+I﹣(aq)I3﹣(aq)的△H>0
B.利用该反应可以除去硫粉中少量的碘单质
C.在上述平衡体系中加入苯,平衡不移动
D.25℃时,在上述平衡体系中加入少量KI固体,平衡常数K小于680
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(15分)重铬酸钾是一种重要的化工原料,一般由铬铁矿制备,铬铁矿的主要成分为FeOCr2O3 , 还含有硅、铝等杂质.制备流程如图所示:
回答下列问题:
(1)步骤①的主要反应为:FeOCr2O3+Na2CO3+NaNO3 ![]() Na2CrO4+Fe2O3+CO2+NaNO2上述反应配平后FeOCr2O3与NaNO3的系数比为 . 该步骤不能使用陶瓷容器,原因是 .
Na2CrO4+Fe2O3+CO2+NaNO2上述反应配平后FeOCr2O3与NaNO3的系数比为 . 该步骤不能使用陶瓷容器,原因是 .
(2)滤渣1中含量最多的金属元素是 , 滤渣2的主要成分是及含硅杂质.
(3)步骤④调滤液2的pH使之变(填“大”或“小”),原因是(用离子方程式表示).
(4)有关物质的溶解度如图所示.
向“滤液3”中加入适量KCl,蒸发浓缩,冷却结晶,过滤得到K2Cr2O7固体.冷却到(填标号)得到的K2Cr2O7固体产品最多.
a.80℃ b.60℃ c.40℃ d.10℃
步骤⑤的反应类型是 .
(5)某工厂用m1 kg 铬铁矿粉(含Cr2O3 40%)制备K2Cr2O7 , 最终得到产品 m2 kg,产率为 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com