
【题目】按要求写出相关的方程式:
(1)写出电解饱和食盐水的化学方程式
(2)氯化铵溶液呈现酸碱性的离子方程式
(3)乙醇和氧气以KOH为电解质的溶液形成的燃料电池的负极电极反应式
【答案】
(1)2NaCl+2H2O ![]() ?2NaOH+Cl2↑+H2↑
?2NaOH+Cl2↑+H2↑
(2)NH4++H2O?NH3?H2O+H+
(3)C2H5OH+16OH﹣﹣12e﹣=2CO32﹣+11H2O
【解析】解:(1)电解饱和食盐水阳极上氯离子失电子发生氧化反应得到氯气,电解反应2Cl﹣﹣2e﹣=Cl2↑,阴极上氢离子得到电子生成氢气,电解反应为2H++2e﹣=H2↑,总反应为2NaCl+2H2O ![]() 2NaOH+Cl2↑+H2↑,所以答案是:2NaCl+2H2O
2NaOH+Cl2↑+H2↑,所以答案是:2NaCl+2H2O ![]() 2NaOH+Cl2↑+H2↑;(2)氯化铵溶液呈现酸碱性的离子方程式:NH4++H2ONH3H2O+H+ , 所以答案是:NH4++H2ONH3H2O+H+;(3)乙醇在负极发生氧化反应生成碳酸根离子和水,离子方程式为:C2H5OH+16OH﹣﹣12e﹣=2CO32﹣+11H2O,所以答案是:C2H5OH+16OH﹣﹣12e﹣=2CO32﹣+11H2O.
2NaOH+Cl2↑+H2↑;(2)氯化铵溶液呈现酸碱性的离子方程式:NH4++H2ONH3H2O+H+ , 所以答案是:NH4++H2ONH3H2O+H+;(3)乙醇在负极发生氧化反应生成碳酸根离子和水,离子方程式为:C2H5OH+16OH﹣﹣12e﹣=2CO32﹣+11H2O,所以答案是:C2H5OH+16OH﹣﹣12e﹣=2CO32﹣+11H2O.


 期末100分闯关海淀考王系列答案
期末100分闯关海淀考王系列答案 小学能力测试卷系列答案
小学能力测试卷系列答案科目:高中化学 来源: 题型:
【题目】铝粉与某些金属氧化物组成的混合物叫铝热剂,铝热剂在高温下发生的反应叫铝热反应.如:2Al+Fe2O3 ![]() 2Fe+Al2O3 , 反应发生时放出大量的热.仔细阅读上述信息回答下列问题:
2Fe+Al2O3 , 反应发生时放出大量的热.仔细阅读上述信息回答下列问题:
(1)“铝热反应”属于四种基本反应类型中的反应.
(2)信息中的“某些”指(填“比铝活泼的”“比铝不活泼的”或“任意”).
(3)试写出铝粉与MnO2发生的铝热反应方程式 .
(4)铝热反应可用于野外焊接钢轨,原因是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图两圆圈相交的部分表示圆圈内的物质相互发生的反应.已知钠及其氧化物的物质的量均为0.1mol,水的质量为100g.下列说法正确的是( ) 
A.反应③最多能产生0.1 mol O2
B.反应①的离子方程式为Na+2H2O═Na++2OH﹣+H2↑
C.Na2O2中阴阳离子数目之比为1:1
D.①②③充分反应后所得溶液中溶质的质量分数:②=③>①
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期金属元素甲~戊在元素周期表中的相对位置如下表所示。下列判断正确的是( )

A. 原子半径:丙<丁<戊 B. 金属性:甲>丙
C. 氢氧化物碱性:丙>丁>戊 D. 最外层电子数:甲>乙
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I、(1)3.3gH3PO2物质的量为___________,其中含有_______ mol H,含有________个O,含磷元素_________ g,若它可与2g NaOH完全反应生成正盐,则H3PO2为_________元酸。
(2)在9.5g某二价金属的氯化物中含有0.2mol Cl-,此氯化物的摩尔质量为________________。
II、在原子序数1—18号元素中(稀有气体元素除外):
(1)原子半径最小的是____________________,原子半径最大的是____________________。
(2)最高价氧化物对应的水化物碱性最强的是____________________(填化学式)。
(3)最高价氧化物对应的水化物酸性最强的是____________________(填化学式)。
(4)与水反应最剧烈的金属是____________________。
(5)比较Si、N最简单氢化物的稳定性:____________________(用化学式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,把试管放入盛有25℃的饱和石灰水的烧杯中,试管中开始放入几小块镁片,再用滴管滴入5mL盐酸于试管中.试回答下列回答: 
(1)实验中观察到的现象是 .
A.试管中镁片逐渐溶解
B.试管中产生无色气泡
C.烧杯外壁变冷
D.烧杯底部析出少量白色固体
(2)试管中发生的反应属于(选填“氧化还原反应”或“非氧化还原反应”).
(3)写出有关反应的离子方程式 .
(4)由实验推知,MgCl2溶液和H2的总能量(填“大于”“小于”“等于”)镁片和盐酸的总能量.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A. 第IA族又叫碱金属元素,第VIIA族元素又叫卤族元素,0族元素又叫稀有气体元素
B. Ba(OH)2碱性比Ca(OH)2强
C. 元素周期表有7个主族,7个副族,1个0族,1个第Ⅷ族,共18纵行
D. X2+的核外电子数目为18,则X在第四周期第ⅡA族
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各表述与示意图一致的是( )
A.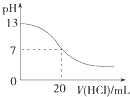 图表示25℃时,用0.1 molL﹣1盐酸滴定20 mL 0.1 molL﹣1 NaOH溶液,溶液的pH随加入酸体积的变化
图表示25℃时,用0.1 molL﹣1盐酸滴定20 mL 0.1 molL﹣1 NaOH溶液,溶液的pH随加入酸体积的变化
B.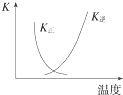 图中曲线表示反应2SO2(g)+O2(g)2SO3(g)△H<0正、逆反应的平衡常数K随温度的变化
图中曲线表示反应2SO2(g)+O2(g)2SO3(g)△H<0正、逆反应的平衡常数K随温度的变化
C.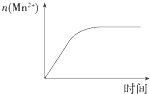 图表示10 mL 0.01 molL﹣1 KMnO4酸性溶液与过量的0.1 molL﹣1 H2C2O4溶液混合时,n(Mn2+)随时间的变化
图表示10 mL 0.01 molL﹣1 KMnO4酸性溶液与过量的0.1 molL﹣1 H2C2O4溶液混合时,n(Mn2+)随时间的变化
D.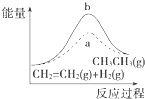 图中a、b曲线分别表示反应CH2═CH2(g)+H2(g)﹣→CH3CH3(g)△H<0使用和未使用催化剂时,反应过程中的能量变化
图中a、b曲线分别表示反应CH2═CH2(g)+H2(g)﹣→CH3CH3(g)△H<0使用和未使用催化剂时,反应过程中的能量变化
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com