
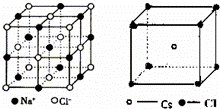
认真分析NaCl和CsCl的晶体结构,判断下列说法错误的是( )
|
| A. | NaCl和CsCl都属于AB型的离子晶体 |
|
| B. | NaCl和CsCl晶体中阴、阳离子个数比相同,所以阴、阳离子的配位数相等 |
|
| C. | NaCl和CsCl晶体中阴、阳离子的配位数分别为6和8 |
|
| D. | NaCl和CsCl都属于AB型的离子晶体,所以阴、阳离子半径比相同 |
考点:
离子化合物的结构特征与性质;离子晶体.
专题:
化学键与晶体结构.
分析:
A.由离子构成的晶体为离子晶体;
B.结合图可知,NaCl为立方面向结构,CsCl为立方体心结构;
C.NaCl晶体中,由体心的钠离子看出周围的氯离子,CsCl晶体中,由体心的铯离子看出周围的氯离子;
D.钠离子半径小于铯离子半径.
解答:
解:A.NaCl和CsCl都是由离子构成的晶体,离子个数之比为1:1,则都属于AB型的离子晶体,故A正确;
B.结合图可知,NaCl为立方面向结构,钠离子的配位数为6,CsCl为立方体心结构,铯离子的配位数为8,故B错误;
C.NaCl晶体中,由体心的钠离子看出周围有6个氯离子,CsCl晶体中,由体心的铯离子看出周围有8个氯离子,故C正确;
D.NaCl和CsCl都属于AB型的离子晶体,由离子的电子层越多,离子半径越大可知钠离子半径小于铯离子半径,故D错误;
故选BD.
点评:
本题考查离子化合物及离子晶体,注意晶体的结构分析是学生解答的难点,即选项BC为解答的易错点和难点,题目难度不大.


科目:高中化学 来源: 题型:
在某无色透明的酸性溶液中,能共存的离子组是()
A. Na+、K+、SO42﹣、HCO3﹣ B. Cu2+、K+、SO42﹣、NO3﹣
C. Na+、K+、Cl﹣、NO3﹣ D. Fe3+、K+、SO42﹣、Cl﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于金属晶体的叙述正确的是( )
|
| A. | 常温下,金属单质都以金属晶体形式存在 |
|
| B. | 金属离子与自由电子之间的强烈作用,在一定外力作用下,不因变形而消失 |
|
| C. | 钙的熔沸点低于钾 |
|
| D. | 温度越高,金属的导电性越好 |
查看答案和解析>>
科目:高中化学 来源: 题型:
以共价单键相连的非金属单质中,1个原子与相邻原子成键的数目为(8﹣N)个,N为该非金属元素的族序数,这一现象被化学家称为8﹣N规则.某非金属单质的结构如图所示,构成该单质的元素位于( )

|
| A. | 第ⅢA族 | B. | 第ⅣA族 | C. | 第ⅤA族 | D. | 第ⅥA族 |
查看答案和解析>>
科目:高中化学 来源: 题型:
R为1~18号元素,其原子所具有的电子层数为最外层电子数的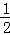 ,它可能形成的含氧酸根离子有:①R2O42﹣,②RO42﹣,③R2O32﹣,④RO32﹣,下列叙述判断正确的是( )
,它可能形成的含氧酸根离子有:①R2O42﹣,②RO42﹣,③R2O32﹣,④RO32﹣,下列叙述判断正确的是( )
|
| A. | 当它可以形成①时,不可能形成④ |
|
| B. | 当它可以形成②时,可以形成③和④ |
|
| C. | 当它可以形成①时,不可能形成②和③ |
|
| D. | 当它形成②时,也可以形成① |
查看答案和解析>>
科目:高中化学 来源: 题型:
二氯化二硫(S2Cl2)是广泛用于橡胶工业的硫化剂,其分子结构如图所示.常温下S2Cl2是一种橙黄色的液体,遇水易水解,并产生能使品红褪色的气体.下列说法错误的是( )
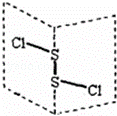
|
| A. | S2Cl2的结构式为Cl﹣S﹣S﹣Cl |
|
| B. | S2Cl2为含有极性键和非极性键的极性分子 |
|
| C. | S2Br2与S2Cl2结构相似,分子间作用力:S2Br2>S2Cl2 |
|
| D. | S2Cl2与H2O反应的化学方程式可能为:2S2Cl2+2H2O═SO2↑+4HCl |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列实验过程中产生的现象与如图所示座标图形相符合的是()
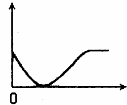
A. 稀盐酸滴加到一定量NaHCO3,溶液中(横坐标是稀盐酸的体积,纵坐标为气体体积)
B. NaOH溶液滴入Ba(HCO3)2溶液中(横坐标是NaOH溶液的体积,纵坐标为沉淀质量)
C. 稀盐酸滴加到AgNO3溶液中(横坐标是稀盐酸的体积,纵坐标为溶液的导电能力)
D. 稀硫酸滴加到Ba(OH)2溶液中(横坐标是稀硫酸的体积,纵坐标为溶液的导电能力)
查看答案和解析>>
科目:高中化学 来源: 题型:
离子方程式:RO3n﹣+3S2﹣+6H+═R﹣+3S↓+3H2O.由此可知在RO3n﹣中,元素R的化合价是()
A. +4 B. +5 C. +6 D. +7
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com