
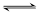 2NH3,下列说法正确的是
2NH3,下列说法正确的是| A.增加N2的量,可以加快反应速率 |
| B.当N2和H2全部转化为NH3时,反应达到最大限度 |
| C.达到平衡时,H2和NH3的浓度比一定为3∶2 |
| D.分别用N2和NH3来表示该反应的速率时,数值大小相同 |
 星级口算天天练系列答案
星级口算天天练系列答案 芒果教辅达标测试卷系列答案
芒果教辅达标测试卷系列答案科目:高中化学 来源:不详 题型:单选题
 NaCl(l)+ K(g)选取适宜的温度,使K成蒸气从反应混合物中分离出来
NaCl(l)+ K(g)选取适宜的温度,使K成蒸气从反应混合物中分离出来| A.①③⑤⑥⑦ | B.②④⑤⑥⑦ | C.①②④⑤⑥ | D.全部 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| 物质 | X | Y | Z |
| 初始浓度/mol·L-1 | 0.1 | 0.2 | 0 |
| 平衡浓度/mol·L-1 | 0.05 | 0.05 | 0.1 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.0.3mol | B.0.15mol |
| C.小于 0.15mol | D.大于0.15mol而小于 0.3mol |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 SiF4(g)+ 2H2O(g) △H=-148.9 kJ·mol-1
SiF4(g)+ 2H2O(g) △H=-148.9 kJ·mol-1| A.2v正(HF)= v逆(H2O) | B.v正(H2O)=2v逆(SiF4) |
| C.SiO2的质量保持不变 | D.容器内压强不变 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
A.FeCl3+3NH4SCN Fe(SCN)3+3NH4Cl溶液显红色,加少量NH4Cl固体后颜色变浅 Fe(SCN)3+3NH4Cl溶液显红色,加少量NH4Cl固体后颜色变浅 |
| B.红棕色NO2加压后颜色先变深后变浅 |
| C.SO2催化氧化成SO3的反应,往往需要使用催化剂 |
| D.H2、I2、HI平衡混和气加压后颜色变深 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 2C(g)达到平衡的标志
2C(g)达到平衡的标志查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 2Z(g)达到平衡时,各物质的平衡浓度为c(X)=0.5mol/L;c(Y) ="0.1" mol /L ; c (Z)="1.6" mol /L若用a、b、c 分别表示X Y Z的初始浓度(mol/L)则a、b应满足的关系是________ ____, a的取值范围为_______________
2Z(g)达到平衡时,各物质的平衡浓度为c(X)=0.5mol/L;c(Y) ="0.1" mol /L ; c (Z)="1.6" mol /L若用a、b、c 分别表示X Y Z的初始浓度(mol/L)则a、b应满足的关系是________ ____, a的取值范围为_______________ dD(g)+eE(g),建立平衡后,维持温度不变而压强改变,测得D的浓度变化如下:
dD(g)+eE(g),建立平衡后,维持温度不变而压强改变,测得D的浓度变化如下:| 压强(Pa) | 4×105 | 6×105 | 10×105 | 20×105 |
| D的浓度(mol/L) | 0.085 | 0.126 | 0.200 | 0.440 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 H2(g) + CO2(g) ΔH=" Q" kJ·mol-1,其平衡常数随温度的变化如下表:
H2(g) + CO2(g) ΔH=" Q" kJ·mol-1,其平衡常数随温度的变化如下表:| 温度/℃ | 400 | 500 | 850 |
| 平衡常数 | 9.9 4 4 | 9 | 1 |

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com