
【题目】既能用酸性高锰酸钾溶液鉴别,又能用溴的四氯化碳溶液鉴别的一组物质是( )
A. 苯与甲苯 B. 己烷与苯 C. 乙烯与乙炔 D. 乙烯与乙烷
科目:高中化学 来源: 题型:
【题目】反应A(g)+3B(g)===2C(g)+2D(g)在四种不同情况下的反应速率分别为
①v(A)=0.45 mol·L-1·min-1 ②v(B)=0.6 mol·L-1·s-1
③v(C)=0.4 mol·L-1·s-1 ④v(D)=0.45 mol·L-1·s-1
下列有关反应速率的比较中正确的是
A.①>②>③>④ B.④<③=②<① C.④>③=②>① D.④>③>②>①
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知2NO2![]() N2O4(无色气体)。a的容积保持不变,b的上盖可随容器内气体压强的改变而上下移动,以保持容器内外压强相等。保持温度不变,将等量的NO2充入“起始态”相同的容器a、b中,同时开始反应。
N2O4(无色气体)。a的容积保持不变,b的上盖可随容器内气体压强的改变而上下移动,以保持容器内外压强相等。保持温度不变,将等量的NO2充入“起始态”相同的容器a、b中,同时开始反应。

(1)5min后,容器a中反应达到平衡,此时测得N2O4的浓度为0.15mol/L,则前5minNO2的平均反应速率为 ;b中达到平衡所需要的时间 5min。(填“>”、“<”或“=”)
(2)达到平衡时,b中的密度变为原来的4/3倍,则NO2转化率为 。
(3)下列信息能说明上述反应在b中达到平衡状态的是
A.每消耗2molNO2,同时生成1molN2O4
B.反应容器内的压强不再发生变化
C.气体的平均相对分子质量不再发生变化
D.气体的密度不再发生变化
E.2v(NO2)正=v(N2O4)逆
F.容器内颜色不再变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
(1)在仪器a 分液漏斗 b 试剂瓶 c 集气瓶 d 滴定管 e 容量瓶f 量筒 g 托盘天平中,标有“0”刻度的是________(填序号,有2个选项)。
(2)“磨砂”是增加玻璃仪器密封性的一种处理工艺,在下列仪器中,没有用到“磨砂”工艺处理的有________(填序号,有2个选项)。
a.试管
b.分液漏斗
c.带滴管的试剂瓶(滴瓶)
d.碱式滴定管
e.酸式滴定管
(3)用装置甲、乙、丙和乳胶管组成一套装置(气密性已检查),可用于制取并收集NH3或HCl气体,可供选择的液体试剂有:浓硫酸、浓盐酸、浓氨水,丙中试剂为紫色石蕊溶液。试回答下列问题:
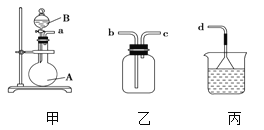
① 若制取某气体的过程中,丙中的石蕊溶液变红,且烧瓶中的试剂A与分液漏斗中的试剂B均为无色液体,则试剂A为________,制取该气体利用了B的性质有________、_____ 。
通过丙中紫色石蕊溶液变红或变蓝,说明乙中气体已集满。若石蕊溶液变蓝,则烧瓶甲中应加入的固体试剂A为________。
②若在乙中收集氨气,气体流经装置的顺序是:a→____→_____→d(填接口代号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】依曲替酯是一种皮肤病用药,它可以由原料X经过多步反应合成。

下列说法不正确的是( )
A.原料X与中间体Y互为同分异构体
B.原料X可以使酸性KMnO4溶液褪色
C.中间体Y能发生加成、取代、消去、氧化、还原反应
D.1 mol依曲替酯能与2 mol NaOH发生反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有可逆反应Fe(s)+CO2(g) ![]() FeO(s) + CO(g),已知在温度938K时,平衡常数K=1.5,在1173K时,K=2.2。
FeO(s) + CO(g),已知在温度938K时,平衡常数K=1.5,在1173K时,K=2.2。
(1)能判断该反应达到平衡状态的依据是 (双选,填序号)。
A.容器内压强不变了
B.C(CO)不变了
C.v正(CO2)=v逆(CO)
D.C(CO2):c(CO)=1:1
(2)该反应的逆反应是_________(选填“吸热”、“放热”)反应。
(3)写出该反应的平衡常数表达式__________。若起始时把Fe和CO2放入体积固定的密闭容器中,CO2的起始浓度为2.0mol/L,某温度时达到平衡,此时容器中CO的浓度为1.0 mol/L,则该温度下上述反应的平衡常数K=__________(保留二位有效数字)。
(4)若该反应在体积固定的密闭容器中进行,在一定条件下达到平衡状态,如果改变下列条件,反应混合气体中CO2的物质的量分数如何变化(选填“增大”、“减小”、“不变”)。①升高温度__________;②再通入CO___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素周期表是学习物质结构和性质的重要工具,下图是元素周期表的一部分,表中所列序号①—⑧分别代表一种元素。

请用相应的元素符号或化学式回答下列问题。
(1)表中金属性最强的元素是 ,③、④、⑤的原子半径由大到小的顺序是 。
(2)①与②形成分子的空间结构可能是 (填序号)。
(3)①与⑦形成的化合物的电子式为 ,其中所含化学键的类型是 。
(4)④的最高氧化物对应的水化物是 ,它与⑥的一种氧化物反应的离子方程式是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用某矿渣(含有Cu2O、Al2O3,Fe2O3、SiO2)制取铜的操作流程如下:
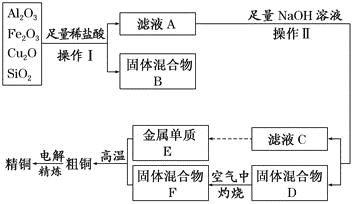
已知:Cu2O+2H+= Cu+Cu2++H2O
(1)实验操作Ⅰ的名称为 ;在空气中灼烧固体混合物D时,用到多种硅酸盐质的仪器,除玻璃棒、酒精灯、泥三角外,还有 (填仪器名称)。
(2)滤液A中铁元素的存在形式为 (填离子符号),生成该离子的离子方程式为 ,检验滤液A中存在该离子的试剂为 (填试剂名称)。
(3)金属E与固体F发生的某一反应可用于焊接钢轨,该反应的化学方程式为 。
(4)常温下,等pH的NaAlO2和NaOH两份溶液中,由水电离出的c(OH-)前者为后者的108倍,则两种溶液的pH= 。
(5)利用电解法进行粗铜精炼时,下列叙述正确的是 (填代号)。
a.电能全部转化为化学能
b.粗铜接电源正极,发生氧化反应
c.精铜作阴极,电解后电解液中Cu2+浓度减小
d.粗铜精炼时通过的电量与阴极析出铜的量无确定关系
(6)从浓硫酸、浓硝酸、蒸馏水中选用合适的试剂,测定粗铜样品中金属铜的质量分数,涉及的主要步骤为:称取一定质量的样品→ →过滤、洗涤、干燥→称量剩余固体铜的质量。(填缺少的操作步骤,说出主要操作方法,不必描述操作过程的细节)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【物质结构与性质】A、B、C、D、E、F为原子序数依次增大的前四周期六种元素,A2-和B+具有相同的电子层结构;C、E为同周期元素,C核外电子总数是最外层电子数的3倍;E元素最外层有一个未成对电子;F的最外层只有1个电子,但次外层有18个电子。
请回答下列问题:
(1)基态F原子的核外电子排布式为 ,F2+能与足量氨水反应得到深蓝色透明溶液,该深蓝色离子的结构式为 。
(2)六种元素中电负性最小的是 ,其中C、D、E的第一电离能由大到小顺序为 (填元素符号)。
(3)A、B 的氢化物所属的晶体类型分别为 。
(4)指出A、D的简单氢化物中沸点较高的物质并说明原因 。
(5)C和E的单质反应可生成组成比为1︰3的化合物,该化合物的立体构型名称为 ,中心原子的杂化轨道类型为 。
(6)A和B能够形成化合物Y,其晶胞结构如图所示,晶胞参数为a nm,Y的化学式为 ,列式计算晶体Y的密度(可不化简) g·cm-3。
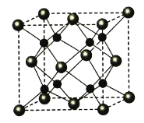
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com