
【题目】已知2NO2![]() N2O4(无色气体)。a的容积保持不变,b的上盖可随容器内气体压强的改变而上下移动,以保持容器内外压强相等。保持温度不变,将等量的NO2充入“起始态”相同的容器a、b中,同时开始反应。
N2O4(无色气体)。a的容积保持不变,b的上盖可随容器内气体压强的改变而上下移动,以保持容器内外压强相等。保持温度不变,将等量的NO2充入“起始态”相同的容器a、b中,同时开始反应。

(1)5min后,容器a中反应达到平衡,此时测得N2O4的浓度为0.15mol/L,则前5minNO2的平均反应速率为 ;b中达到平衡所需要的时间 5min。(填“>”、“<”或“=”)
(2)达到平衡时,b中的密度变为原来的4/3倍,则NO2转化率为 。
(3)下列信息能说明上述反应在b中达到平衡状态的是
A.每消耗2molNO2,同时生成1molN2O4
B.反应容器内的压强不再发生变化
C.气体的平均相对分子质量不再发生变化
D.气体的密度不再发生变化
E.2v(NO2)正=v(N2O4)逆
F.容器内颜色不再变化
【答案】(1)0.06mol/(L·min);<;(2)50% ;(3)CDF。
【解析】
试题分析:(1)5min后,容器a中反应达到平衡,此时测得N2O4的浓度为0.15mol/L,则前5minNO2的平均反应速率为v(NO2)=2v(N2O4)=2×(0.15mol/L÷5min) =)0.06mol/(L·min);应用b是在恒压下进行,反应过程中物质的浓度大于a,浓度越大,反应速率越快,所以b中达到平衡所需要的时间<5min。(2)达到平衡时,b中的密度变为原来的4/3倍,则容器的容积是原理的3/4,由于反应前后气体的质量不变,根据2NO2![]() N2O4可知,加入开始有2molNO2气体,每有2mol NO2发生反应,气体的物质的量减小1mol,容器的容积减小1/2,现在 容器的容积减小1/4mol,则有1/2mol NO2发生反应,NO2转化率为(1/2mol÷1mol)×100%=50%;(3)A.表示反应正向进行,任何时刻都存在该转化关系,错误;B.该反应是在恒压下进行,任何时刻反应体系的压强都不变,所以不能判断反应是否达到平衡,错误;C.若气体的平均相对分子质量不在发生变化,则气体的物质的量不变,反应达到平状态,正确;D.若气体的密度不再发生变化,则任何气体的物质的量不变,反应达到平衡状态,正确;E.2v(NO2)正=v(N2O4)逆,表示反应逆向进行,未达到平衡状态,错误;F.在混合气体中只有NO2是有色气体,若容器内颜色不再变化,说明任何物质的浓度不变,反应达到平衡状态,正确。
N2O4可知,加入开始有2molNO2气体,每有2mol NO2发生反应,气体的物质的量减小1mol,容器的容积减小1/2,现在 容器的容积减小1/4mol,则有1/2mol NO2发生反应,NO2转化率为(1/2mol÷1mol)×100%=50%;(3)A.表示反应正向进行,任何时刻都存在该转化关系,错误;B.该反应是在恒压下进行,任何时刻反应体系的压强都不变,所以不能判断反应是否达到平衡,错误;C.若气体的平均相对分子质量不在发生变化,则气体的物质的量不变,反应达到平状态,正确;D.若气体的密度不再发生变化,则任何气体的物质的量不变,反应达到平衡状态,正确;E.2v(NO2)正=v(N2O4)逆,表示反应逆向进行,未达到平衡状态,错误;F.在混合气体中只有NO2是有色气体,若容器内颜色不再变化,说明任何物质的浓度不变,反应达到平衡状态,正确。


 科学实验活动册系列答案
科学实验活动册系列答案科目:高中化学 来源: 题型:
【题目】在室温时,同种规格的铝片分别与下列物质混合,反应开始时生成氢气速率最大的是
A.0.1mol/L盐酸15ml
B.0.15mol/L硫酸8ml
C.0.2mol/L盐酸12ml
D.18mol/L硫酸15ml
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁炭混合物(铁屑和活性炭的混合物)、纳米铁粉均可用于处理水中污染物。
(1)铁炭混合物在水溶液中可形成许多微电池。将含有Cr2O72-的酸性废水通过铁炭混合物,在微电池正极上Cr2O72-转化为Cr3+,其电极反应式为_____________。
(2)在相同条件下,测量总质量相同、铁的质量分数不同的铁炭混合物对水中Cu2+和Pb2+的去除率,结果如右图所示。

①当铁炭混合物中铁的质量分数为0时,也能去除水中少量的Cu2+和Pb2+,其原因是__________。
②当铁炭混合物中铁的质量分数大于50%时,随着铁的质量分数的增加,Cu2+和Pb2+的去除率不升反降,其主要原因是_____________。
(3)纳米铁粉可用于处理地下水中的污染物。
①一定条件下,向FeSO4溶液中滴加碱性NaBH4溶液,溶液中BH4-(B元素的化合价为+3)与Fe2+反应生成纳米铁粉、H2和B(OH)4-,其离子方程式为 。
②纳米铁粉与水中NO3-反应的离子方程式为 4Fe+ NO3-+10H+=4Fe2++NH4++3H2O,研究发现,若pH偏低将会导致NO3-的去除率下降,其原因是 。
③相同条件下,纳米铁粉去除不同水样中NO3-的速率有较大差异(见右图),产生该差异的可能原因是 。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢氧燃料电池可以使用在航天飞机上,其反应原理示意图如下图。下列有关氢氧燃料电池的说法正确的是
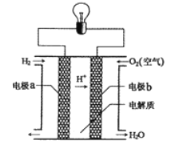
A.该电池工作时电能转化为化学能
B.该电池中电极a是正极
C.外电路中电子由电极b通过导线流向电极a
D.该电池的总反应:2H2+O2=2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以乙烷燃料电池为电源进行电解的实验装置如图所示。下列说法正确的是
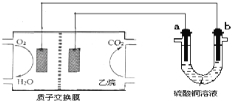
A.燃料电池工作时,正极反应为O2+2H2O+4e-═ 4OH-
B.a极是铜,b极是铁时,硫酸铜溶液浓度减小
C.a、b两极若是石墨,在同温同压下a极产生的气体与电池中消耗的乙烷体积的比为7/2
D.a极是纯铜,b极是粗铜时,a极上有铜析出,b极逐渐溶解,两极质量变化相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.乙烯是石油裂解气的主要成分,下图是石蜡油在炽热碎瓷片的作用下裂解,下列装置检验其性质,完成下列问题。

(1)A中碎瓷片的作用是_____________。
(2)B中反应类型是_____________,C中实验现象是__________________。
II.用如图所示的装置进行实验,回答下列问题:
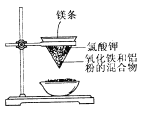
(1)写出该反应的化学方程式:_____________________。
(2)选出该实验的实验现象(把序号填写在横线上):________________。
①镁条剧烈燃烧;②放出大量的热,并发出耀眼的光芒;③纸漏斗的下部被烧穿;④有红热状态的液珠落入蒸发皿内的细沙上,液珠冷却后变为黑色固体。
(3)写出下列操作或物质的作用:镁条________;氯酸钾_________;蒸发皿盛沙____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】目前世界上60%的镁是从海水中提取的。海水提镁的主要流程如下:

请同答下列问题:
(1)石灰乳是生石灰与水形成的化合物,从充分利用海洋化学资源,提高经济效益的角度考虑,生产生石灰的主要原料来源于海洋中的________,其生产方程式___________。从离子反应的角度思考,往海水中加入石灰乳的作用是______________。
(2)操作A是____,操作B是______。
(3)加入的足量试剂a是_______(填化学式)。
(4)无水MgCl2在熔融状态下,通电后会产生Mg和Cl2,该反应的化学方程式为___________,从考虑成本和废物循环利用的角度,副产物氯气可以用于____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素单质及其化合物有广泛用途,请根据周期表中第三周期元素相关知识回答下列问题:
(1)按原子序数递增的顺序(稀有气体除外),以下说法正确的是________。
a.原子半径和离子半径均减小
b.金属性减弱,非金属性增强
c.氧化物对应的水化物碱性减弱,酸性增强
d.单质的熔点降低
(2)原子最外层电子数与次外层电子数相同的元素名称为________,氧化性最弱的简单阳离子是________。
(3)已知:
化合物 | MgO | Al2O3 | MgCl2 | AlCl3 |
类型 | 离子化合物 | 离子化合物 | 离子化合物 | 共价化合物 |
熔点/℃ | 2800 | 2050 | 714 | 191 |
工业制镁时,电解MgCl2而不电解MgO的原因是_______________________________ ___;
制铝时,电解Al2O3而不电解AlCl3的原因是____________________________ __。
(4)晶体硅(熔点1410 ℃)是良好的半导体材料,SiCl4(熔点-70 ℃)。由粗硅制纯硅过程如下:
![]()
SiCl4属于 晶体。在上述由SiCl4制纯硅的反应中,测得每生成1.12 kg纯硅需吸收a kJ热量,写出该反应的热化学方程式:______________________________________ 。
(5)P2O5是非氧化性干燥剂,下列气体不能用浓硫酸干燥,可用P2O5干燥的是________。
a.NH3b.HI c.SO2d.CO2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com