
【题目】I.乙烯是石油裂解气的主要成分,下图是石蜡油在炽热碎瓷片的作用下裂解,下列装置检验其性质,完成下列问题。

(1)A中碎瓷片的作用是_____________。
(2)B中反应类型是_____________,C中实验现象是__________________。
II.用如图所示的装置进行实验,回答下列问题:
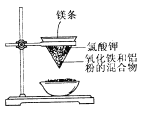
(1)写出该反应的化学方程式:_____________________。
(2)选出该实验的实验现象(把序号填写在横线上):________________。
①镁条剧烈燃烧;②放出大量的热,并发出耀眼的光芒;③纸漏斗的下部被烧穿;④有红热状态的液珠落入蒸发皿内的细沙上,液珠冷却后变为黑色固体。
(3)写出下列操作或物质的作用:镁条________;氯酸钾_________;蒸发皿盛沙____________。
【答案】I.(1)催化作用;(2)氧化反应;溴的四氯化碳溶液褪色;
II.(1)Fe2O3+2Al![]() Al2O3+2Fe
Al2O3+2Fe
(2)①②③④(少选一个扣一分,只写两个不得分)
(3)引燃剂;助燃剂;防止溅落物炸裂蒸发皿 (每空2分)。
【解析】
试题分析:(1)在石蜡分解反应中,加入碎瓷片的作用是催化作用;(2)石蜡分解会产生乙烯等不饱和烃,乙烯具有还原性,可以被酸性高锰酸钾溶液氧化,所以B中反应类型是氧化反应;乙烯分子中含有碳碳双键,可以与溴水或溴的四氯化碳溶液,发生加成反应产生1,2-二溴乙烷,因此可观察到C中实验现象是溴的四氯化碳溶液褪色;II.(1)在纸漏斗中会发生铝热反应,该反应的化学方程式是Fe2O3+2Al![]() Al2O3+2Fe;(2)发生铝热反应的步骤是①引燃镁条,会看到镁条剧烈燃烧;②反应放出大量的热,并发出耀眼的光芒;③镁条燃烧放出的大量的热为铝热反应提供了能量,发生反应:Fe2O3+2Al
Al2O3+2Fe;(2)发生铝热反应的步骤是①引燃镁条,会看到镁条剧烈燃烧;②反应放出大量的热,并发出耀眼的光芒;③镁条燃烧放出的大量的热为铝热反应提供了能量,发生反应:Fe2O3+2Al![]() Al2O3+2Fe,反应放热,使产生的铁以液态形式存在,液态铁及热的氧化铝将纸漏斗的下部烧穿;④铁以红热状态的液珠落入蒸发皿内的细沙上,液珠冷却后变为黑色固体。故反应现象的序号依次是①②③④;(3)在铝热反应中不同的物质的作用不相同,其中镁条的作用是引燃剂;氯酸钾的作用是为铝热反应分解产生氧气,故起助燃剂的作用;蒸发皿盛沙目的是防止溅落物炸裂蒸发皿。
Al2O3+2Fe,反应放热,使产生的铁以液态形式存在,液态铁及热的氧化铝将纸漏斗的下部烧穿;④铁以红热状态的液珠落入蒸发皿内的细沙上,液珠冷却后变为黑色固体。故反应现象的序号依次是①②③④;(3)在铝热反应中不同的物质的作用不相同,其中镁条的作用是引燃剂;氯酸钾的作用是为铝热反应分解产生氧气,故起助燃剂的作用;蒸发皿盛沙目的是防止溅落物炸裂蒸发皿。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】硫酸亚铁晶体(FeSO4·7H2O)在医药上作补血剂。为测定补血剂中铁元素的含量,某化学兴趣小组设计了两套实验方案。
方案一 滴定法:用酸性KMnO4溶液滴定,测定铁元素的含量
(1)写出该滴定反应的离子方程式 。
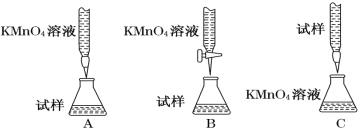
(2)某同学设计的下列滴定方式中,最合理的是________(夹持部分略去)(填字母序号)
(3)实验前,首先要精确配制一定物质的量浓度的KMnO4溶液250 mL,配制时需要的仪器除天平、药匙、烧杯、胶头滴管外,还需 (填仪器名称)。
在溶液配制过程中,下列操作会导致配制结果偏低的是___________(填写代号)。
a. 定容时,俯视容量瓶刻度线
b. 容量瓶在使用前内有少量蒸馏水
c. 转移溶液后的烧杯、玻璃棒未洗涤
d. 定容后摇匀,发现液面降低,又补加少量水,重新达到刻度线
(4)上述实验中KMnO4溶液需要酸化,用于酸化的酸是________。
a.浓盐酸 b.稀硫酸 c.稀硝酸 d.浓硫酸
方案二 称量法:操作流程如下:

(5)写出步骤②中H2O2氧化Fe2+ 的离子方程式______ __。
步骤②中除用H2O2外还可以使用的物质是
步骤②是否可以省略 ,理由是 。
(6)步骤④一系列操作依次是:过滤、洗涤、 、冷却、称量。
(7)假设实验无损耗,则每片补血剂含铁元素的质量 g(用含a的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水热法制备纳米颗粒Y(化合物)的反应为:
3Fe2++2S2O32-+O2+aOH-=Y+S4O62-+2H2O。下列说法中,不正确的是
A.S2O32-是还原剂
B.Y的化学式为Fe2O3
C.a=4
D.每有1 mol O2参加反应,转移的电子总数为4 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高炉炼铁是冶炼铁的主要方法,发生的主要反应为:
Fe2O3(s)+3CO(g) ![]() 2Fe(s)+3CO2(g) ΔH = a kJ mol-1
2Fe(s)+3CO2(g) ΔH = a kJ mol-1
(1)已知: ①Fe2O3(s)+3C(石墨) = 2Fe(s)+3CO(g) ΔH1 = + 489.0 kJ mol-1
②C(石墨)+CO2(g) = 2CO(g) ΔH2 = + 172.5 kJ mol-1
则a = kJ mol-1。
(2)冶炼铁反应的平衡常数表达式K = ,温度升高后,K值 (填“增大”、“不变”或“减小”)。
(3)在T℃时,该反应的平衡常数K=64,在2 L恒容密闭容器甲和乙中,分别按下表所示加入物质,反应经过一段时间后达到平衡。
Fe2O3 | CO | Fe | CO2[ | |
甲/mol | 1.0 | 1.0 | 1.0 | 1.0 |
乙/mol | 1.0 | 2.0 | 1.0 | 1.0 |
① 甲容器中CO的平衡转化率为 。
② 下列说法正确的是 (填字母)。
a.若容器内气体密度恒定时,标志反应达到平衡状态
b.甲容器中CO的平衡转化率大于乙的
c.甲、乙容器中,CO的平衡浓度之比为2∶3
d.增加Fe2O3可以提高CO的转化率
(4)采取一定措施可防止钢铁腐蚀。下列装置中的烧杯里均盛有等浓度、等体积的NaCl溶液。
①在a~c装置中,能保护铁的是 (填字母)。
②若用d装置保护铁,X极的电极材料应是 (填名称)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知2NO2![]() N2O4(无色气体)。a的容积保持不变,b的上盖可随容器内气体压强的改变而上下移动,以保持容器内外压强相等。保持温度不变,将等量的NO2充入“起始态”相同的容器a、b中,同时开始反应。
N2O4(无色气体)。a的容积保持不变,b的上盖可随容器内气体压强的改变而上下移动,以保持容器内外压强相等。保持温度不变,将等量的NO2充入“起始态”相同的容器a、b中,同时开始反应。

(1)5min后,容器a中反应达到平衡,此时测得N2O4的浓度为0.15mol/L,则前5minNO2的平均反应速率为 ;b中达到平衡所需要的时间 5min。(填“>”、“<”或“=”)
(2)达到平衡时,b中的密度变为原来的4/3倍,则NO2转化率为 。
(3)下列信息能说明上述反应在b中达到平衡状态的是
A.每消耗2molNO2,同时生成1molN2O4
B.反应容器内的压强不再发生变化
C.气体的平均相对分子质量不再发生变化
D.气体的密度不再发生变化
E.2v(NO2)正=v(N2O4)逆
F.容器内颜色不再变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是A、B、C、D、E五种有机物的有关信息:
A | B | C | D | E |
①是一种烃,能使溴的四氯化碳溶液褪色 ②比例模型为:
③能与水在一定条件下反应生成C | ①由C、H两种元素组成 ②球棍模型为:
| ①能与钠反应,但不能与NaOH溶液反应; ②能与E反应生成相对分子质量为100的酯 | ①由C、H、Br三种元素组成; ②相对分子质量为109 | ①由C、H、O三种元素组成; ②球棍模型为:
|
根据表中信息回答下列问题:
(1)写出A使溴的四氯化碳溶液褪色的化学方程式:________________________;
(2)A与氢气发生加成反应后生成分子F,F的同系物的通式为CnH2n+2。当n =________时,这类有机物开始有同分异构体。
(3)B的分子式为________,写出在浓硫酸作用下,B与浓硝酸反应的化学方程式:___ ;
(4)D→A所加试剂及反应条件为____________________;反应类型为__________________;
(5)C与E反应能生成相对分子质量为100的酯,写出该反应的化学方程式:_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
(1)在仪器a 分液漏斗 b 试剂瓶 c 集气瓶 d 滴定管 e 容量瓶f 量筒 g 托盘天平中,标有“0”刻度的是________(填序号,有2个选项)。
(2)“磨砂”是增加玻璃仪器密封性的一种处理工艺,在下列仪器中,没有用到“磨砂”工艺处理的有________(填序号,有2个选项)。
a.试管
b.分液漏斗
c.带滴管的试剂瓶(滴瓶)
d.碱式滴定管
e.酸式滴定管
(3)用装置甲、乙、丙和乳胶管组成一套装置(气密性已检查),可用于制取并收集NH3或HCl气体,可供选择的液体试剂有:浓硫酸、浓盐酸、浓氨水,丙中试剂为紫色石蕊溶液。试回答下列问题:
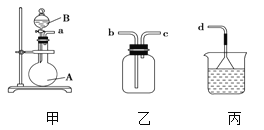
① 若制取某气体的过程中,丙中的石蕊溶液变红,且烧瓶中的试剂A与分液漏斗中的试剂B均为无色液体,则试剂A为________,制取该气体利用了B的性质有________、_____ 。
通过丙中紫色石蕊溶液变红或变蓝,说明乙中气体已集满。若石蕊溶液变蓝,则烧瓶甲中应加入的固体试剂A为________。
②若在乙中收集氨气,气体流经装置的顺序是:a→____→_____→d(填接口代号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有可逆反应Fe(s)+CO2(g) ![]() FeO(s) + CO(g),已知在温度938K时,平衡常数K=1.5,在1173K时,K=2.2。
FeO(s) + CO(g),已知在温度938K时,平衡常数K=1.5,在1173K时,K=2.2。
(1)能判断该反应达到平衡状态的依据是 (双选,填序号)。
A.容器内压强不变了
B.C(CO)不变了
C.v正(CO2)=v逆(CO)
D.C(CO2):c(CO)=1:1
(2)该反应的逆反应是_________(选填“吸热”、“放热”)反应。
(3)写出该反应的平衡常数表达式__________。若起始时把Fe和CO2放入体积固定的密闭容器中,CO2的起始浓度为2.0mol/L,某温度时达到平衡,此时容器中CO的浓度为1.0 mol/L,则该温度下上述反应的平衡常数K=__________(保留二位有效数字)。
(4)若该反应在体积固定的密闭容器中进行,在一定条件下达到平衡状态,如果改变下列条件,反应混合气体中CO2的物质的量分数如何变化(选填“增大”、“减小”、“不变”)。①升高温度__________;②再通入CO___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】径A>B>C;②D、E是非金属元素且为相邻周期元素,它们跟氢化合可生成气态氢化物HD和HE,在室温时,D的单质是液体,E的单质是固体;③F的单质在常温下是气体,性质很稳定,是除氢外最轻的气体;④G是除氢外原子半径最小的元素。
(1)B位于周期表中第______周期_____族,C的原子结构示意图是 。
(2)E的单质颜色是____________________。
(3)A元素与D元素形成化合物的电子式是__________________。
(4)G的单质与水反应的化学方程式是 。
(5)F的元素符号是_____________________。
(6)在上述七种元素中,最高价氧化物对应的水化物碱性最强的化学式是_________,酸性最强的化学式是_______________,气态氢化物最稳定的化学式是______________。
(7)将C的氧化物对应的水化物投入到A的氧化物对应的水化物中反应的离子方程式是:__________________________________________ _。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com