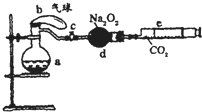
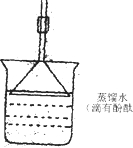
(2008?开封一模)如图所示装置中:a是盛有标准状况下的空气(氧气占
)和10mL 1.2mol/L硝酸的250mL烧瓶;b是未充气(实验开始前内部没有气体)放有0.384g铜粉的气球;c是夹紧了弹簧夹;d中盛有足量的过氧化钠;e是充有二氧化碳的针铜.整套装置已经过气密性检查合格.
(1)将气球中的铜粉小心倒入烧瓶中,充分反应后发现铜粉有剩余(设产生的气体不溶解于溶液中),则可观察到的现象是
溶液变蓝色,烧瓶内气体由无色继而变成红色,气球胀大
溶液变蓝色,烧瓶内气体由无色继而变成红色,气球胀大
.
(2)欲提高铜与硝酸反应的速率可采用多种不同的措施.若用加入化学试剂法,下列试剂中可以选用的是
D
D
.
A.蒸馏水 B.无水醋酸钠 C.铜粉 D.少量硝酸银溶液
(3)将烧瓶不断振荡发现气球逐渐缩小,反应的化学方程式是
4NO2+O2+2H2O=4HNO3 或4NO+3O2+2H2O=4HNO3
4NO2+O2+2H2O=4HNO3 或4NO+3O2+2H2O=4HNO3
,此时气球是全部在烧瓶外还是一部分进入烧瓶?
有一部分被吸入烧瓶
有一部分被吸入烧瓶
.
(4)打开弹簧夹c,将二氧化碳推入干燥管内,继续振荡烧瓶,使气体与气体、溶液充分接触,欲使所有的铜粉全溶解,至少需要推入二氧化碳
38.4
38.4
mL.
(5)将上述过程用一个总的化学方程式表示
2Cu+4HNO3+O2=2Cu(NO3)2+2H2O
2Cu+4HNO3+O2=2Cu(NO3)2+2H2O
.

 (2008?开封一模)如图所示装置中:a是盛有标准状况下的空气(氧气占
(2008?开封一模)如图所示装置中:a是盛有标准状况下的空气(氧气占

 教材全解字词句篇系列答案
教材全解字词句篇系列答案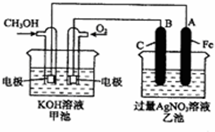 (2008?枣庄一模)如图是一个化学反应过程的示意图.已知甲池的总反应式为:
(2008?枣庄一模)如图是一个化学反应过程的示意图.已知甲池的总反应式为: (2008?开封一模)短周期元素的常见单质A、B、C、D在通常状况下均为气态,其中B分子中共价键最多,单质A分别与B、C、D在一定条件下发生反应,得到相应的共价化合物E、F、G,通常状况下F为液体,E、G为气体,且E与G可反应得到离子化合物H,H中的阳离子含有10个电子,阴离子含有18个电子.
(2008?开封一模)短周期元素的常见单质A、B、C、D在通常状况下均为气态,其中B分子中共价键最多,单质A分别与B、C、D在一定条件下发生反应,得到相应的共价化合物E、F、G,通常状况下F为液体,E、G为气体,且E与G可反应得到离子化合物H,H中的阳离子含有10个电子,阴离子含有18个电子.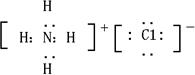
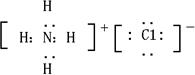

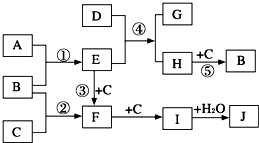 (2009?开封一模)如图是部分短周期元素的单质及其化合物的转化关系图(有关反应的条件及生成的H2O已略去).
(2009?开封一模)如图是部分短周期元素的单质及其化合物的转化关系图(有关反应的条件及生成的H2O已略去).