
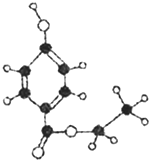
 (2008?开封一模)尼泊金醋是国际上公认的广谱性高效食品防腐剂,如图是一种尼泊金酯的球棍模型.下列有关说法正确的是( )
(2008?开封一模)尼泊金醋是国际上公认的广谱性高效食品防腐剂,如图是一种尼泊金酯的球棍模型.下列有关说法正确的是( )

 核心素养学练评系列答案
核心素养学练评系列答案 单元期中期末卷系列答案
单元期中期末卷系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 (2008?开封一模)短周期元素的常见单质A、B、C、D在通常状况下均为气态,其中B分子中共价键最多,单质A分别与B、C、D在一定条件下发生反应,得到相应的共价化合物E、F、G,通常状况下F为液体,E、G为气体,且E与G可反应得到离子化合物H,H中的阳离子含有10个电子,阴离子含有18个电子.
(2008?开封一模)短周期元素的常见单质A、B、C、D在通常状况下均为气态,其中B分子中共价键最多,单质A分别与B、C、D在一定条件下发生反应,得到相应的共价化合物E、F、G,通常状况下F为液体,E、G为气体,且E与G可反应得到离子化合物H,H中的阳离子含有10个电子,阴离子含有18个电子.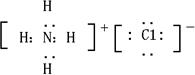
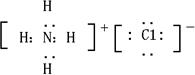
| ||
| △ |
| ||
| △ |

查看答案和解析>>
科目:高中化学 来源: 题型:
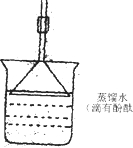
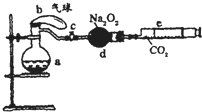 (2008?开封一模)如图所示装置中:a是盛有标准状况下的空气(氧气占
(2008?开封一模)如图所示装置中:a是盛有标准状况下的空气(氧气占| 1 | 5 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com