
| A、②⑤①④③ |
| B、⑤②①③④ |
| C、①②③④⑤ |
| D、⑤①②④③ |


 举一反三期末百分冲刺卷系列答案
举一反三期末百分冲刺卷系列答案科目:高中化学 来源: 题型:
| A、在20℃,1.01×105Pa时,11.2L氧气所含的原子数为NA |
| B、0.1mol/L 的NaCl溶液中,Na+与Cl-离子总数为0.2NA |
| C、在标准状况下,2mol酒精的体积约为44.8L |
| D、常温常压下,质量为32g的O2含有的分子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在常温常压下,11.2LN2含有的分子数为NA |
| B、在标准状况下,18 gH2O所占的体积约是22.4L |
| C、32gO2在标准状况下所占的体积约为22.4L |
| D、在同温同压下,相同体积的任何气体单质所含的原子数相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1:34 | B、1:17 |
| C、2.3:1 | D、4.6:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
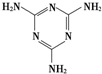 (双项)三聚氰胺(结构式如图所示)是一种重要的化工原料,可用于阻燃剂、水泥减水剂和高分子合成等领域.一些不法分子却往牛奶中加入三聚氰胺,以提高奶制品的含氮量.下列说法正确的是( )
(双项)三聚氰胺(结构式如图所示)是一种重要的化工原料,可用于阻燃剂、水泥减水剂和高分子合成等领域.一些不法分子却往牛奶中加入三聚氰胺,以提高奶制品的含氮量.下列说法正确的是( )| A、三聚氰胺不属于蛋白质 |
| B、三聚氰胺是高分子化合物 |
| C、三聚氰胺分子中含有碳碳双键 |
| D、三聚氰胺的分子式为C3H6N6 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、同主族金属元素的原子半径越大熔点越高 |
| B、稀有气体原子序数越大沸点越低 |
| C、分子间作用力越弱的分子其沸点越低 |
| D、同周期元素的原子半径越小越易失去电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、含H+的溶液显酸性,含OH-的溶液显碱性 |
| B、用丁达尔现象实验可区分葡萄糖溶液和氢氧化铁胶体 |
| C、某饱和溶液变成不饱和溶液,溶质的质量分数一定减小 |
| D、向含有BaCl2和NaOH的混合液中通入足量的二氧化硫,最终会有白色沉淀生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、都能跟强碱溶液反应,都不会跟酸反应 |
| B、都是通过共价键形成,熔点和沸点都比较高 |
| C、Si能跟某些非金属反应,SiO2跟任何非金属都不反应 |
| D、都能跟烧碱反应,都不会跟纯碱反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com