
【题目】已知25℃时,RSO4(s)+CO32-(aq)![]() RCO3(s)+SO42-(aq)的平衡常数K=1.75×104,Ksp(RCO3)=2.80×10-9,下列叙述中正确的是
RCO3(s)+SO42-(aq)的平衡常数K=1.75×104,Ksp(RCO3)=2.80×10-9,下列叙述中正确的是
A. 向c(CO32-)=c(SO42-)的混合液中滴加RCl2溶液,首先析出RSO4沉淀
B. 将浓度均为6×10-6mol/L的RCl2、Na2CO3溶液等体积混合后可得到RCO3沉淀
C. 25℃时,RSO4的Ksp约为4.9×10-5
D. 相同温度下,RCO3在水中的Ksp大于在Na2CO3溶液中的Ksp
【答案】C
【解析】RSO4(s)+CO32-(aq)![]() RCO3(s)+SO42-(aq)的平衡常数K=
RCO3(s)+SO42-(aq)的平衡常数K=![]() =
=![]() =
=![]() =1.75
=1.75![]() 104,Ksp(RSO4)=1.75
104,Ksp(RSO4)=1.75![]() 104
104![]() Ksp(RCO3)=1.75
Ksp(RCO3)=1.75![]() 104
104![]() 2.80
2.80![]() 10-9=4.9
10-9=4.9![]() 10-5。A项,RSO4、RCO3属于同种类型且Ksp(RSO4)
10-5。A项,RSO4、RCO3属于同种类型且Ksp(RSO4)![]() Ksp(RCO3),向c(CO32-)=c(SO42-)的混合液中滴加RCl2溶液,首先析出RCO3沉淀,A项错误;B项,将浓度均为6
Ksp(RCO3),向c(CO32-)=c(SO42-)的混合液中滴加RCl2溶液,首先析出RCO3沉淀,A项错误;B项,将浓度均为6![]() 10-6mol/LRCl2、Na2CO3溶液等体积混合后,c(R2+)=3
10-6mol/LRCl2、Na2CO3溶液等体积混合后,c(R2+)=3![]() 10-6mol/L、c(CO32-)=3
10-6mol/L、c(CO32-)=3![]() 10-6mol/L,此时的离子积Qc=c(R2+)·c(CO32-)=3
10-6mol/L,此时的离子积Qc=c(R2+)·c(CO32-)=3![]() 10-6
10-6![]() 3
3![]() 10-6=9
10-6=9![]() 10-12
10-12![]() Ksp(RCO3),不会产生RCO3沉淀,B项错误;C项,根据上述计算,Ksp(RSO4)=4.9
Ksp(RCO3),不会产生RCO3沉淀,B项错误;C项,根据上述计算,Ksp(RSO4)=4.9![]() 10-5,C项正确;D项,Ksp只与温度有关,与浓度无关,相同温度下RCO3在水中的Ksp与在Na2CO3溶液中的Ksp相等,D项错误;答案选C。
10-5,C项正确;D项,Ksp只与温度有关,与浓度无关,相同温度下RCO3在水中的Ksp与在Na2CO3溶液中的Ksp相等,D项错误;答案选C。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】因瓦合金是铁和镍的合金,由于其膨胀系数极小,又称不变合金,适合做测量元件。回答下列问题:
(1)基态镍原子的价电子轨道表达式为_______;铁的基态原子核外未成对电子数为_______个。
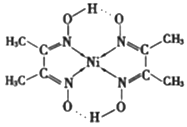
(2)在稀氨水介质中,Ni2+与丁二酮肟(分子式为C4H8N2O2)反应可生成鲜红色沉淀,其分子结构如下图所示,该结构中碳原子的杂化方式为_______;已知丁二酮肟分子结构中C-C键与N-O键的键长和键能数据如下表所示,请从原子结构角度解释N-O键的键能小于C-C键:_______。
化学键 | 键长 (10-12m) | 键能 (kJ/mol) |
C-C | 154 | 332 |
N-O | 146 | 230 |
(3)铁、镍易与CO作用形成羰基配合物Fe(CO)5、N(CO)4。1个Fe(CO)5分子中含有σ键数目为_______;已知Ni(CO)4分子为正四面体构型,下列溶剂能够溶解Ni(CO)4的是_______(填写字母)。
A.四氯化碳 B.苯 C.水 D.液氨
(4)镍晶胞为面心立方,其中镍原子的配位数为_______。氯化亚铁的熔点为674℃,而氯化铁的熔点仅为282℃,二者熔点存在差异的原因是_______。
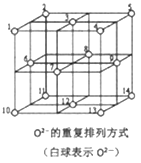
(5)Fe3O4晶体中,O2-的重复排列方式如右图所示,该排列方式中存在着由如1、3、6、7的O2-围成的正四面体空隙和3、6、7、8、9、12的O2-围成的正八面体空隙。Fe3O4中有一半的Fe3+填充在正四面体空隙中,另一半Fe3+和Fe2+填充在正八面体空隙中,则Fe3O4晶体中,正四面体空隙数与O2-数之比为_______。Fe3O4晶胞中有8个图示结构单元,晶体密度为5.18g/cm3,则该晶胞参数a=_______cm(写出计算表达式即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】所示装置进行探究实验。以验证产物中有乙烯生成且乙烯具有不饱和性.当温度迅速上升后,可观察到试管中溴水褪色,烧瓶中浓硫酸与乙醇的混合液体变为棕黑色。

(1)写出该实验中生成乙烯的化学方程式_________________________。
(2)甲同学认为:考虑到该混合液体反应的复杂性,溴水褪色的现象不能证明反应中有乙烯生成,且乙烯具有不饱和性,其理由正确的是_________________________。(填字母序号)
A.乙烯与溴水易发生取代反应 B.使溴水褪色的反应,未必是加成反应
C.使溴水褪色的物质,未必是乙烯 D.浓硫酸氧化乙醇生成乙醛,也会使溴水褪色
(3)乙同学经过细致观察后认为试管中另一现象可证明反应中有乙烯生成,这个现象是________________________________。
(4)丙同学对上述实验装置进行了改进,在I和Ⅱ之间增加如图2所示装置,则A中的试剂应为______________,其作用是_____________,B中的试剂为_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.高铁酸钾(K2FeO4)是一种新型、高效、多功能绿色水处理剂,比Cl2、O2、ClO2、KMnO4氧化性更强,无二次污染,工业上是先制得高铁酸钠,然后在低温下,向高铁酸钠溶液中加入KOH至饱和,使高铁酸钾析出。
(1)干法制备高铁酸钠的主要反应为:2FeSO4 + 6 Na2O2 = 2Na2FeO4 + 2Na2O + 2Na2SO4 + O2↑,该反应中还原剂是___________________(填化学式),被2 mol FeSO4还原的过氧化钠为_________mol
(2)湿法制备高铁酸钾(K2FeO4)的反应体系中有六种微粒:Fe(OH)3、ClO-、OH-、FeO42-、Cl-、H2O。写出碱性条件下制高铁酸钾的离子反应方程式:__________________________
Ⅱ.已知:2Fe3++2I-=2Fe2++I2,2Fe2++Br2=2Fe3++2Br-。
(1)含有1 mol FeI2和2 mol FeBr2的溶液中通入2 mol Cl2,此时被氧化的离子是____________,被氧化的离子的物质的量分别是_____________________________________________
(2)若向含a mol FeI2和b mol FeBr2的溶液中通入c mol Cl2,当I-、Fe2+被氧化时,c为_____________(用含a、b的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】绿色化学的核心就是利用化学原理从源头上减少和消除工业生产对环境的污染。下列做法不符合绿色化学理念的是( )
A.研制水溶剂涂料替代有机溶剂涂料
B.用可降解塑料生产包装盒或快餐盒
C.用反应:![]() 制备硫酸铜
制备硫酸铜
D.用反应:![]() 制备环氧乙烷
制备环氧乙烷
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可以用来鉴别甲烷和乙烯,还可以用来除去甲烷中混有的少量乙烯的操作方法是( )
A.将混合气体通过盛有硫酸的洗气瓶
B.将混合气体通过盛有足量溴水的洗气瓶
C.将混合气体通过盛有水的洗气瓶
D.将混合气体通过盛有澄清石灰水的洗气瓶
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】11.2g Fe加入一定量的HNO3充分反应后,生成Fe2+、Fe3+的物质的量之比为1:4,将生成的气体NXOY与一定量的O2混合后通入水中,反应后无气体剩余(NXOY+O2+H2O-HNO3 ),则通入的氧气的物质的量是
A. 0.12mol B. 0.14mol C. 0.2mol D. 0.13mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com