
【题目】我国科研人员以蹄叶橐吾为原料先制得化合物Ⅰ再转化为具有抗癌抑菌活性的倍半萜化合物Ⅱ,有关转化如图所示,下列有关说法不正确的是
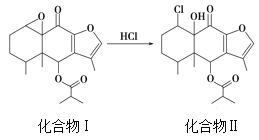
A. 化合物Ⅰ能使酸性KMnO4溶液褪色
B. 化合物Ⅰ分子中含有5个手性碳原子
C. 化合物Ⅱ一定条件下能发生取代、消去及加成反应
D. 检验化合物Ⅱ是否含化合物Ⅰ可用Br2的CCl4溶液
 轻松课堂单元测试AB卷系列答案
轻松课堂单元测试AB卷系列答案 小题狂做系列答案
小题狂做系列答案科目:高中化学 来源: 题型:
【题目】锌及其化合物用途广泛。火法炼锌以闪锌矿(主要成分是ZnS)为主要原料,涉及的主要反应有:①2ZnS(s)+3O2(g)=2ZnO(s)+2SO2(g)△H1=﹣930kJmol-1
②2C(s)+O2(g)=2CO(g)△H2=﹣221kJmol-1
③ZnO(s)+CO(g)=Zn(g)+CO2(g)△H3=+198kJmol-1
(1)反应ZnS(s)+C(s)+2O2(g)=Zn(g)+CO2(g)+SO2(g)的△H4=____kJmol-1。
反应中生成的CO2与NH3混合,在一定条件下反应合成尿素:2NH3(g)+CO2(g)![]() CO(NH2)2(s)+H2O(g) △H。若该反应在一恒温、恒容密闭容器内进行,判断反应达到平衡状态的标志是___。
CO(NH2)2(s)+H2O(g) △H。若该反应在一恒温、恒容密闭容器内进行,判断反应达到平衡状态的标志是___。
a.CO2与H2O(g)浓度相等 b.容器中气体的压强不再改变
c.2v(NH3)正=v(H2O)逆 d.容器中混合气体的密度不再改变
(2)亚硝酰氯(NOCl)是有机合成中的重要试剂,可由NO与Cl2在一定条件下合成:2NO(g)+Cl2(g)![]() 2NOCl(g) △H<0。保持恒温恒容条件,将物质的量之和为3mol的NO和Cl2以不同的氮氯比[n(NO)/n(Cl2)]进行反应,平衡时某反应物的转化率与氮氯比及不同温度的关系如图所示:
2NOCl(g) △H<0。保持恒温恒容条件,将物质的量之和为3mol的NO和Cl2以不同的氮氯比[n(NO)/n(Cl2)]进行反应,平衡时某反应物的转化率与氮氯比及不同温度的关系如图所示:
①图中T1、T2的关系为:T1___T2(填“>”、“<”或“=”);
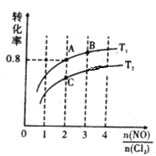
②图中纵坐标为物质___的转化率;
③图中A、B、C三点对应的NOCl体积分数最大的是____(填“A”、“B”、或“C”);
④若容器容积为2L,则B点的平衡常数的值为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】网络表情包“苯宝宝装纯(醇)”,该分子由“苯宝宝”拿一个氢原子换了个羟基形成,下列说法不正确的是
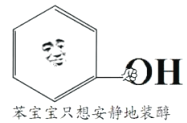
A. 苯宝宝只想安静地装醇,说明该分子不是醇
B. 该分子中所有原子一定共面
C. 该分子能和Na发生置换反应生成H2
D. 该分子苯环上的一个氢原子被-C4H9取代所得的同分异构体有12种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:①I2(g)+H2(g)![]() 2HI(g)+26.5kJ、②I2(s)+H2(g)
2HI(g)+26.5kJ、②I2(s)+H2(g)![]() 2HI(g)-9.5kJ,下列分析正确的是
2HI(g)-9.5kJ,下列分析正确的是
A.①是放热反应,无需加热即可发生
B.②需持续不断加热才能发生反应
C.I2(g)和I2(s)的能量关系如图所示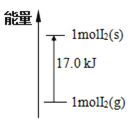
D.1molI2(s)和1molH2(g)的能量之和比2molHI(g)能量高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将250mL含BaCl2和KCl的混合溶液分成5等份,取一份加入含a mol硫酸钠的溶液,恰好使钡离子完全沉淀;另取一份加入含b mol硝酸银的溶液,恰好使氯离子完全沉淀。则原混合溶液中钾离子物质的量浓度为
A. 4(b-2a)mol/L B. 20(2a-b)mol/L
C. 20(b-2a)mol/L D. 10(b-a)mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物D具有抗病毒作用,如图是利用Heck反应合成D的一种路线。
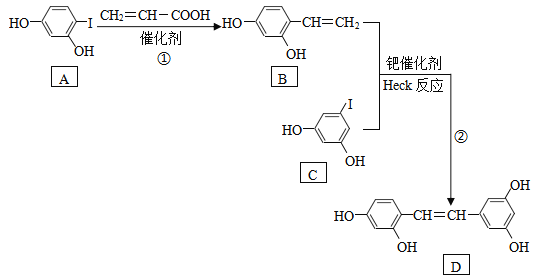
已知Heck反应:R1-X+R2-CH=CH2![]() R1-CH=CH-R2+HX
R1-CH=CH-R2+HX
完成下列填空:
(1)反应①的反应类型是:____________反应。
(2)丙烯酸(CH2=CH-COOH)中官能团的名称是:____________。
(3)写出苯环上只有一个侧链且含-COO-的B的所有同分异构体的结构简式:____________。
(4)利用Heck反应,由苯和乙苯(![]() )为原料制备
)为原料制备![]() ,写出合成路线。(无机试剂任选)_______________________(合成路线的表示方式为:
,写出合成路线。(无机试剂任选)_______________________(合成路线的表示方式为:![]() )。
)。
(5)工业上可用丙烯氧化法生产丙烯酸(CH2=CH-COOH),得到的丙烯酸中往往混有丙烯醛(CH2=CH-CHO)。
①制备过程中,证明已有丙烯酸生成的方法是:____________。
②证明生成的丙烯酸中混有丙烯醛的方法是:____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钼(Mo)是人体及动植物必需的微量元素,且在芯片制作、药物和医学造影等方面也有重要作用。用辉钼矿冶炼金属钼的某反应:MoS2(s)+2Na2CO3(s)+4H2(g)![]() Mo(s)+2CO(g)+4H2O(g)+2Na2S(s),该反应中氢气的平衡转化率与温度、压强的关系如图所示:
Mo(s)+2CO(g)+4H2O(g)+2Na2S(s),该反应中氢气的平衡转化率与温度、压强的关系如图所示:
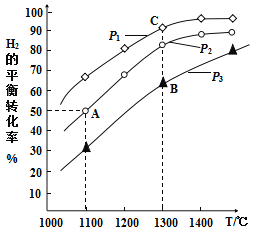
(1)Na2S的电子式为:____________。上述反应的气态反应物和生成物中属于极性分子的是____________(填写化学式)。举出一个事实,说明硫的非金属性比碳强(用化学方程式表示)____________。
(2)写出上述反应的平衡常数表达式K=____________。上述正反应是____________反应(填“吸热”或“放热”)。
(3)1100℃,2L恒容密闭容器中,加入0.1molMoS2、0.2molNa2CO3、0.4molH2,反应至20min时达到的平衡状态恰好处于上图中的A点。此过程中,用H2表示的平均速率为____________。其他条件一定时,B点的速率____________C点(填“大于”“等于”或“小于”),说明理由:____________。
(4)A、B、C三点代表的平衡状态的平衡常数的大小为:KA____________KB____________KC(填“大于”“等于”或“小于”),并说明理由:____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知Ksp(AgCl)=1.56×10-10,Ksp(AgBr)=7.7×10-13 ,Ksp(Ag2CrO4)=9×10-11。某溶液中含有Cl-、Br-和CrO42-,浓度均为0.010mol/L,向该溶液中逐滴加入0.010mol/L的AgNO3溶液时,三种阴离子产生沉淀的先后顺序为( )
A. Cl-、Br-、CrO42-B. Br-、Cl-、CrO42-
C. CrO42-、Br-、Cl-D. Br-、CrO42-、Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学在实验室进行铁盐与亚铁盐相互转化的实验:

实验I:将Fe3+转化为Fe2+
(1)Fe3+与Cu粉发生反应的离子方程式为:_________________。
(2)探究白色沉淀产生的原因,请填写实验方案:
实验方案 | 现象 | 结论 |
步骤1:取4mL____mol/LCuSO4溶液向其中滴加3滴0.1mol/LKSCN溶液 | 产生白色沉淀 | CuSO4与KSCN反应产生了白色沉淀 |
步骤2:取______________,向其中滴加3滴0.1mol/LKSCN溶液 | 无明显现象 |
查阅资料:ⅰ.SCN-的化学性质与I-相似,ⅱ.2Cu2++4I-=2CuI↓+I2
则Cu2+与SCN-反应的离子方程式为________________。
实验Ⅱ:将Fe2+转化为Fe3+
实验方案 | 现象 |
向3mL0.1mol/LFeSO4溶液中加入1mL8mol/L稀硝酸 | 溶液变为棕色,放置一段时间后,棕色 消失,溶液变为黄色 |
探究上述现象出现的原因:
查阅资料:Fe2++NO![]() Fe(NO)2+(棕色)
Fe(NO)2+(棕色)
(3)用离子方程式解释NO产生的原因____________。
(4)从化学反应速率与限度的角度对体系中存在的反应进行分析:
反应Ⅰ:Fe2+与HNO3反应;反应Ⅱ:Fe2+与NO反应
①依据实验现象,甲认为反应Ⅰ的速率比反应Ⅱ_______(填“快”或“慢”)。
②乙认为反应Ⅰ是一个不可逆反应,并通过实验证明其猜测正确,乙设计的实验方案是_________________________。
③请用化学平衡移动原理解释溶液由棕色变为黄色的原因____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com